阿兹海默症:忘却之基因
2014-06-16 16:07:47 来源: 作者: 评论:0 点击:
 随着时间的增长,阿兹海默症患者的大脑会迅速萎缩。
随着时间的增长,阿兹海默症患者的大脑会迅速萎缩。1991年的一天,神经学家Warren Strittmatter请他的导师察看一些令人迷惑的数据。Strittmatter正在研究β类淀粉蛋白,阿兹海默症患者大脑中分子团簇的主要成分。他在寻找脑脊液中β类淀粉蛋白结合蛋白质,并且已经筛选出一种被称为载脂蛋白E(ApoE)的蛋白质,只是它似乎与阿兹海默症并无显著联系。
Strittmatter的导师,杜克大学北卡罗来纳州达勒姆分校的基因学家Allen Roses立刻意识到他的同事无意碰到了令人兴奋的东西。两年以前,研究小组已经验证了阿兹海默症与19号染色体的某个区域的基因上的联系。Roses知道,编码ApoE的基因也在19号染色体上。“这就像是一道闪电在脑海中划过,”他说,“这改变了我的生活。”
人体中,APOE基因有三种变体,或者说等位基因,标记为APOE2、APOE3、APOE4。Roses意识到,接下来的工作显然应该是分析是否只有ApoE基因影响了患上阿兹海默症的风险。这需要利用聚合酶链式反应(PCR)来区分这些等位基因。但是Roses并没有操作PCR的经验。于是他请组内的一位博士后来检测实验组和对照组病人的样本。可是博士后拒绝了。因为他觉得APOE基因不太像是有联系的基因,而他们还要忙于寻找其他可能导致阿兹海默症的基因。这时Roses感到,组里又都认为“老大迷于他疯狂的想法,老大跑偏了”。
于是,Roses求助于他的妻子Ann Saunders。这位精于PCR技术的鼠类基因学家才刚刚产下女儿,正在放产假。所以他们定下了一个约定。“她做实验,我照看女儿。”Roses说。三周之内,他们就已经收集到了足够的数据。这些数据驱动了一系列里程碑式的论文,描述了ApoE基因与阿兹海默症的显著相关性。
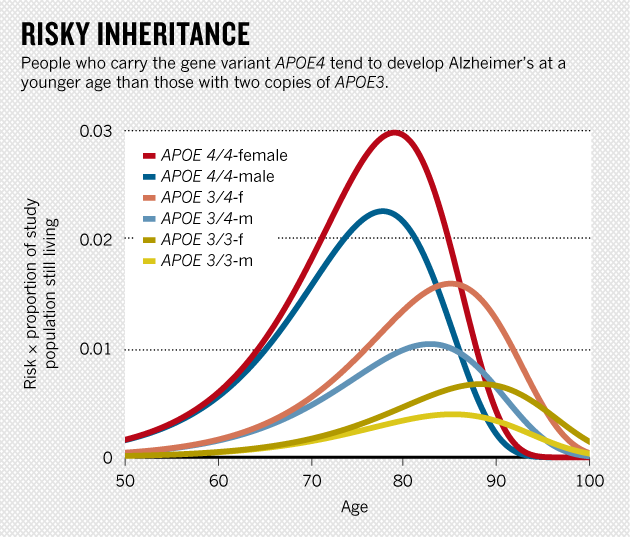
二十年以来,APOE4始终是引起阿兹海默症的头号因素。阿兹海默症是老年痴呆中最常见的一种。等位基因中的一个遗传了APOE4,患上阿兹海默症的概率就翻两番,两个都遗传了APOE4,概率就提高十一倍。但在当时,Roses的数据或被批评或被忽略,鲜有赞同之声。几年之内,对ApoE的关注消弭而研究者都扎堆研究β类淀粉蛋白。少数实验室面对着赞助者和神经学界的冷眼,顶着资金不足的压力,继续研究ApoE,可是也难以进行大型实验验证发现。
时至今日,ApoE蛋白在大脑中的作用还是基本不明朗。研究者对于这样一个明显的线索的忽视,这令阿兹海默症领域之外的人们感到迷惑。在德国法兰克福的一个脑疾病论坛上,Thomas Bourgeron表达了他的疑惑:“假如我看见这样明显的影响因素,我一定穷追不舍。”Thomas Bourgeron现于巴黎巴斯德研究所(the Pasteur Institute in Paris)研究自闭症。
不过现在对于ApoE这种载脂蛋白的关注正在升温。有一部分原因是针对β类淀粉蛋白的研究在大型的临床试验中不断地失败。制药公司开始对相关研究收回资金,而学术界也开始质疑对于β类淀粉蛋白的关注是否有意义。头一次,人们把药物研究的准心瞄向了ApoE蛋白,并且希望把它投入工厂的生产车间中。
“类淀粉蛋白假设已经变成了一个如此之深的科学执念,以至于人们接受它不是因为实验数据而只是单纯地相信。”非营利组织预防阿兹海默症2020(Prevent Alzheimer's Disease 2020)的主席、前美国国家卫生研究院阿兹海默症相关活动协调者Zaven Khachaturian如是说。前不久,他还说道,“不曾有人逐本溯源,去问这个最基本的问题:我们为了研究这疾病所做的基本前提是否正确?”
僵硬的竞争
人们对于为什么Roses的发现被忽略有不同意见。不过许多人都同意一点,天时不利是原因之一。1991年John Hardy和David Allsop发表了“类淀粉蛋白积弊假设”,认为大脑中的类淀粉蛋白的不正常聚集,或者说斑痕,导致了阿兹海默症。其他人也纷纷涌向这一思路。该假设从而赢得该领域内的大部分经费。
可是Roses对两者的联系并不买账。“类淀粉蛋白是大脑中坏死细胞或瘘产生的斑痕的主要成分之一,”他说,“我认为它不可能是引起病变的原因。”他的这一言论,可能令他人在研究ApoE与类淀粉蛋白的关系之前就却步了,同时不经意让两种假设为了争夺经费而竞争起来了。而他也再也没有成功地申请到经费。
而当时ApoE的研究也存在着技术障碍。这种蛋白质在全身都可检出,这就难以瞄准出现在大脑的蛋白质。并且它与脂肪息息相关,所以在生化分析中它容易附着于其他分子。Menelas Pangalos如是说。Menelas Pangalos是地处英国马格斯菲特的阿斯利康制药公司(AstraZeneca in Macclesfield, UK)小分子研究的领导者,他也一直对ApoE十分感兴趣。
研究这种蛋白质需要对脂质化学的深刻理解。“如果你要研究ApoE生物学,你的确得发动整个实验室来理解这些技术细节。”华盛顿大学圣路易斯分校(Washington University in St. Louis, Missouri)的神经学家David Holtzman说到。而他也是这么做的,单独建立了一个针对中央神经系统载脂蛋白的技术研发实验室。
类淀粉蛋白是一个更容易的目标。二十多年来的紧追不舍带来了一系列调整类淀粉蛋白代谢的药物,但还是不能满足人们的期望。在进入第二阶段或第三阶段临床试验的六种药物中,有一半由于安全原因或者效果欠佳而被放弃。在人口老龄化的潮流之下,这令压力巨大的卫生医疗系统和相关药物的短缺现状雪上加霜。“针对阿兹海默症的大型药物试验的失败数目令人咂舌,”加州大学(University of California, San Francisco)的格雷斯通神经疾病研究所(Gladstone Institute of Neurological Disease)的领导Lennart Mucke说,“这确实吓跑了大药厂。”
还剩下的三种针对β类淀粉蛋白的试验中药物,正在阿兹海默症患者以及还未出现症状的高危患病人群中接受测试。成像研究显示,高危人群的大脑在阿兹海默症发作的十多年前,就显示了与对照组不同的特征,甚至在开始积累β类淀粉蛋白或者在损伤灰质之前就已经不同。这次药物试验将会检查这些药物是否预防或者延迟了阿兹海默症的发作。预计六年之内就能得到结论。在这个领域内,不论是学术界还是工业上,越来越多的人们感到,这是类淀粉蛋白假设的最后机会。聚光灯已经从类淀粉蛋白转回了ApoE上。
假如预防试验失败了,那么就需要学术界来说服制药公司重新回到基本的临床前数据以及早期临床数据的探讨。Mucke说道。他很有信心ApoE研究很快就会拿到谈判的筹码。尽管这条道路上荆棘重重,但仍涌现了新想法来解释ApoE如何提高患病风险的原理。 Holtzman与Mucke各自的团队也在探索。他们培养了能表达人类ApoE蛋白的转基因鼠,借此进一步研究。
这个蛋白质分子似乎从两种不同的途径诱发阿兹海默症,其中一种与类淀粉蛋白有关。与ApoE3相比,ApoE4强烈地促进了动物体和人体的大脑内的类淀粉蛋白聚积。而ApoE3长期以来被认为是人与阿兹海默症之间的“中立分子”。ApoE2则是保护性的基因,它减少了大脑内的类淀粉蛋白累积。“这是引人注目的数据”Holtzman说。
另一种途径并不涉及类淀粉蛋白。当神经元在压力下时,会分泌ApoE蛋白来完成修复机制。“邪恶”的ApoE4蛋白则很容易分解为有毒的小碎片,破坏细胞的能源工厂——线粒体——并且改变细胞骨架。
这两种途径影响阿兹海默症的相对程度还不得而知,Holtzman提到。但他和其他人认为修改ApoE的等位基因可能是一个有效的治疗手段。在格雷斯通(Gladstone Institute of Neurological Disease),心血管学家的研究小组,包括神经学家,已经发现了一种小“修正带”分子,可以把ApoE4蛋白的结构修改为类似于ApoE3蛋白的结构,从而减少不正常的分裂。
在细胞培养中,低浓度的“修正带”分子可以减少线粒体损伤和神经元紊乱。借助一系列动物模型,它们正被更严格地检验着。假如这种分子最终被证明对人安全且有效,那么Mucke可以预见到,有一天医生将它作为对高危患病人群的处方,正如现在他汀类药物被开给高胆固醇的和易患心血管疾病的人们一样。
阿兹海默症之外的答案
这种药物甚至也暗示了阿兹海默症之外的答案。“线粒体损伤假设给ApoE4的恶性行为作出了合理而粗略的解释,”Mucke说,“不单单对于阿兹海默症,对于其他疾病也是。”有证据显示ApoE4可能是帕金森氏综合征和癫痫的影响因素。它还和脑损伤后遗症,和不加处理的HIV感染后恶化,有关系。有十五家生物科技公司开始合作研究这种药物及其类似物。
尽管申请不到经费,Roses也没有放弃ApoE的研究。但是在他的小组发现ApoE与阿兹海默症的关系之后,他厌烦了为经费而奔波。他离开了学术界,进入工厂,花费十年研究ApoE及其他,直到2008年才回到杜克大学。
2009年,他的小组描述了一段19号染色体上紧接着APOE的名为TOMM40的DNA片段。这段DNA,简称523,它的长度因人而异。而这段长度,决定了TOMM40和APOE的表达程度。
这项发现很重要,Roses说,因为TOMM40编码的蛋白质,Tom40,对健康的线粒体很关键。Tom40在线粒体膜上形成了运输蛋白质的通道。假如不能运输足够的蛋白质,线粒体就不能正常地分裂。“人们十多年前就了解了这一性质,”Roses说,“但它在阿兹海默症领域还不出名。”
Roses继续提议说应该探索523来研发新疗法和改良阿兹海默症相关试验。绝大部分人只要活得足够久都会患上阿兹海默症,但是只有25%的人APOE4等位基因。因此,凭借APOE4的检测来预测阿兹海默症的参考价值有限。但是,同时检测TOMM40和APOE能够给更广泛的人群提供信息,Roses如是说。举例而言,他的小组发现,人类迄今最常见的APOE等位基因APOE3通常要么和一段特别短的523基因一起遗传,要么和一段特别长的。两等位基因都遗传了APOE3的人,他们患上阿兹海默症的年龄就和其523等位基因的不同组合有关。
其他实验室也发现了支持Roses的假设的证据。但是有的尝试重复Roses的关于TOMM40的发现,结果失败了。2012年,现于伦敦大学学院的(University College London)的Hardy和他的同事基因学家Rita Guerreiro发表了一篇社论。在其中他们认为TOMM40并不独立影响阿兹海默症的患病风险。
Roses对他的假设的信念还没有动摇。他相信他有一个完备的机理来解释他的发现。并且他认为基因组范围的研究之所以不能重现他的结论是因为没有足够的资源来展现TOMM40和阿兹海默症之间的关系。Khachaturian说要验证Roses的发现所要求的合理的试验,还没有完成。
Roses在杜伦(Durham)建立了一家名叫仙芬黛药物(Zinfandel Pharmaceuticals)的公司,其中部分资金还由他自费支持。他希望很快就能收集到能够支持他的发现的临床数据。这家公司与一家日本药物公司竹田(Takeda)一起资助了一项名叫“明日”(TOMMORROW)的第三阶段试验,借此检验他的想法。“明日”预计实行五年,将会招募6000名健康的老年个体。它将评估这个基于年龄、APOE及TOMM40的风险预估算法是否有效。
这次试验同样会检验一种药物,吡格列酮,是否能够在低剂量下推迟那些高风险人群发作的时间。它在高剂量之下已经证明对某些带有二型糖尿病的病人有效。动物试验和小范围的人体试验显示吡格列酮可以防止或者反转一些阿兹海默症相关的病理和症状。Roses猜测它能够刺激线粒体分裂来达到效果。
即使没有给出一个有效的疗法,正在进行的这项试验也会有重大的影响。研究已经表明,及时地干预可以推迟两年发作,这将在50年内为美国减少大约200万名病例。而在几年内,试验结果就会迫使研究者重新审视自己对于痴呆的理解。是时候重新认识阿兹海默症了,Khachaturian说,它是一种综合性的紊乱,涉及一系列的生理系统。单独地看待任何一个生理系统,即使是包涵了ApoE4的系统,也难以完全解释病症行为的变化。“该领域正在认识到现有方法的局限,并且迈回起点。”他说,“假如我们不再自欺欺人,我们就能发现新天地。”
相关热词搜索:
上一篇:马上睡着了,身体却猛抽一下,怎么回事?
下一篇:过度使用现代技术与日后记忆力衰退和抑郁症有关
频道总排行
频道本月排行
热门购物
评论排行
- 2011年临床执业医师考试实践技能真...(13)
- 腋臭手术视频(12)
- 2008年考研英语真题及参考答案(5)
- 节食挑食最伤女人的免疫系统(5)
- 核辐射的定义和单位(5)
- CKD患者Tm与IMT相关(5)
- 齐鲁医院普外科开展“喉返神经监护...(5)
- windows7激活工具WIN7 Activation v1.7(5)
- 正常微循环(5)
- 美大学性教育课来真的 男女上阵亲...(4)