NEJM:阿尔茨海默病新药Solanezumab III期临床试验失败
2014-02-05 12:02:40 来源:37度医学网 作者: 评论:0 点击:
为此,礼来(Eli Lilly)开展了Solanezumab 的两项III期临床研究,令人遗憾的是均以失败告终,相关结果发表在2014年1月23日的《新英格兰医学杂志》上。
该III期临床试验为随机双盲对照研究,以轻到中度阿兹海默氏症患者为研究对象,包括EXPEDITION 1(纳入患者1012例)和EXPEDITION 2(1040例)。研究对象随机分为安慰剂组及solanezumab药物组(400mg 静脉用药),每4周一次给药,为期18个月。(图1)
主要终点事件为80周后以下相关评分的变化:11项阿兹海默氏症认知评分(ADAS-cog11;0到70分, 得分越高认知障碍越重)以及阿兹海默氏症协作研究日常生活能力评分(ADCS-ADL;0到78分,得分越低功能越差)。
分析完EXPEDITION 1数据后,将EXPEDITION 2轻度阿兹海默氏症患者的主要终点事件修正为14项阿兹海默氏症认知评分变化(ADAS-cog14;0到90分, 得分越高认知障碍越重)。(表1)
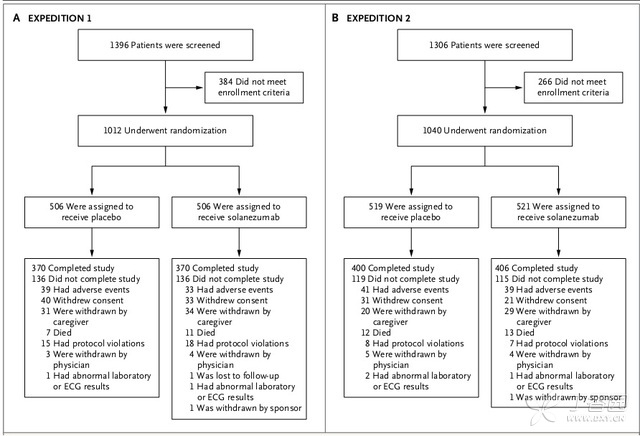
图1.EXPEDITION 1和EXPEDITION 2研究对象入组及试验完成情况
表1.EXPEDITION 1和EXPEDITION 2研究对象一般基线信息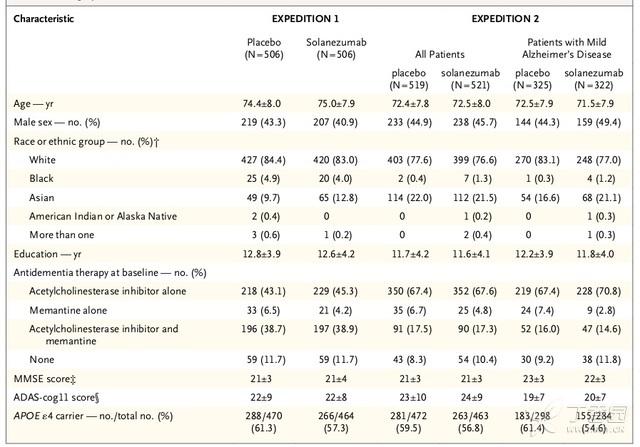
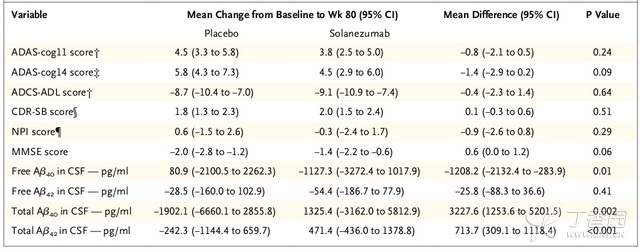
两项III期临床试验结果均表明solanezumab不能明显改善患者的主要终点事件。EXPEDITION 1研究显示,与基线相比,80周后ADAS-cog11评分变化的组间差异(药物组减安慰剂组)为-0.8分(95% CI,−2.1至0.5;P = 0.24),而ADCS-ADL组间差异为-0.4分(95% CI,−2.3 至1.4,P = 0.64)。(表2)
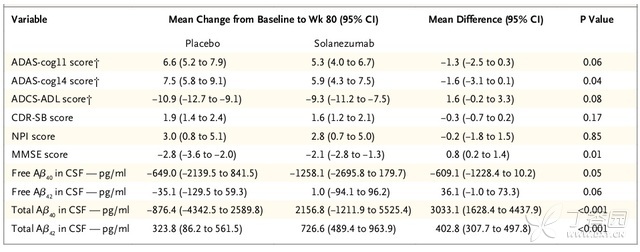
在EXPEDITION 2,ADAS-cog11评分变化的组间差异为-1.3分(95% CI,−2.5至0.3;P = 0.06),ADCS-ADL组间差异为1.6分(95% CI,−0.2至3.3,P = 0.08)(表3)。
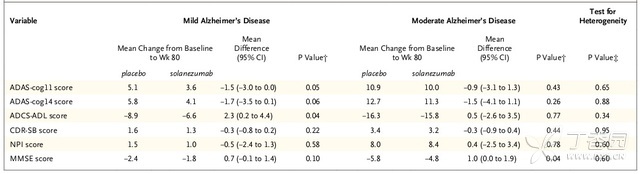
轻度阿尔茨海默氏症患者ADAS-cog14评分变化的组间差异为-1.7分(95% CI, −3.5至0.1; P = 0.06),中度阿尔茨海默氏症患者组间差异为−1.5分(95% CI, −4.1 to 1.1; P = 0.26)(表4)。
总之,该III期临床试验表明Solanezumab不能改善阿兹海默氏症患者认知或者生活能力。但是,在轻度或者无临床症状但是已有证据表明Aβ沉积的阿兹海默氏症患者,Solanezumab疗效如何,仍需更深入的研究。
上一篇:維E或可抗功能衰退
下一篇:一种预防热带杀手利什曼病疫苗的研制
频道总排行
频道本月排行
热门购物
评论排行
- 2011年临床执业医师考试实践技能真...(13)
- 腋臭手术视频(12)
- 2008年考研英语真题及参考答案(5)
- 节食挑食最伤女人的免疫系统(5)
- 核辐射的定义和单位(5)
- CKD患者Tm与IMT相关(5)
- 齐鲁医院普外科开展“喉返神经监护...(5)
- windows7激活工具WIN7 Activation v1.7(5)
- 正常微循环(5)
- 美大学性教育课来真的 男女上阵亲...(4)