ACS抗血小板治疗新时代的到来
2012-04-16 10:36:23 来源:医学论坛网 作者: 评论:0 点击:
抗血小板药物发展历程
ACS是斑块破裂、血栓形成的结果,而血小板激活聚集在动脉血栓进展中起主要作用,是指南明确的ACS主要治疗目标,抗血小板药物也成为了减少 ACS患者远期缺血事件的治疗支柱之一。一项汇集15项研究、19288例ACS患者的荟萃分析也证明,抗血小板药物可显著降低患者非致死性再梗死/卒中 及全因死亡率,全面改善患者预后。
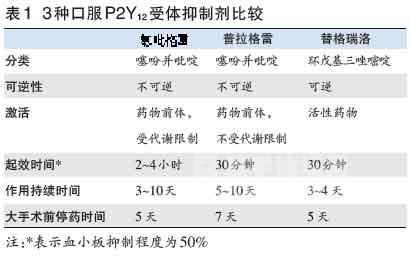
自上世纪60年代双嘧达莫被美国食品与药物管理局(FDA)批准用于抗血小板治疗以来,阿司匹林、噻氯匹定、氯吡格雷、普拉格雷及替格瑞洛等相 继上市。CURE研究显示,在阿司匹林基础上加用P2Y12受体抑制剂氯吡格雷可显著减少不良事件,奠定了ACS双联抗血小板治疗的基础。然而,氯吡格雷 存在个体差异大、受代谢影响、易受其他药物相互作用影响、起效较慢等缺陷,因此急需新一代药物代替。当前被欧洲心脏病学会(ESC)等指南推荐用于ACS 治疗的口服抗血小板药物包括阿司匹林和P2Y12 受体抑制剂氯吡格雷、普拉格雷和替格瑞洛(表1)。阿司匹林可抑制血栓烷A2(TXA2)形成并持续抑 制血小板功能,但在高危患者中不够强效,常要联合一种P2Y12受体抑制剂。氯吡格雷1997年获FDA批准全球上市,普拉格雷和替格瑞洛分别于2009 年和2011年获FDA批准上市。尽管P2Y12受体抑制剂防治ACS的经验多来自氯吡格雷,但最近更新的欧美指南已将替格瑞洛等作为优于氯吡格雷的首选 抗血小板药物。权威指南为何如此信赖肯定新型P2Y12 受体抑制剂?
满足ACS患者治疗需求,选择理想的抗血小板药物
快速起效,为ACS患者“争分夺秒”
对于ACS患者,尽早给予药物或PCI有助于减小梗死面积、降低死亡风险。研究显示,PCI每延迟30分钟,患者1年死亡率升高7.5%;但PCI前快速有效抗血小板可显著降低血栓风险。
既往研究显示,氯吡格雷常规负荷剂量300 mg需6 h才能达理想效应,无法满足急诊PCI需求,加至600 mg虽可在2 h达到相同效 应,但CURRENT-OASIS-7研究显示,600 mg与300 mg组患者30 天心血管死亡、心梗或卒中复合终点发生率相似[4.2%对 (vs.)4.4%],30天严重出血率升高(CURRENT标准为2.5%vs.2.0%;TIMI标准为1.7%vs.1.3%),提示600 mg 并未带来更多益处。可见,通过增加氯吡格雷剂量达到早期快速有效抗血小板似乎并不明智。
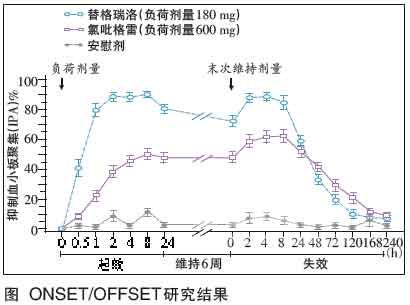
比较3种口服P2Y12 受体抑制剂可见(表1),普拉格雷虽与氯吡格雷同属噻吩并吡啶类,但起效较快,仅需30分钟。替格瑞洛则有别于噻吩并 吡啶类,是第一个直接发挥作用的可逆性P2Y12受体抑制剂,可更快起效和失效。ONSET/OFFSET研究入组123例服用阿司匹林 (75~100 mg/d)的稳定性冠脉疾病患者,结果如图,180 mg负荷剂量替格瑞洛较600 mg负荷剂量氯吡格雷起效更快(30分钟内),抑制 血小板聚集作用(IPA)显著较高(41%vs.8%);在2 h内,替格瑞洛负荷剂量180 mg对血小板聚集的抑制作用达峰值(替格瑞洛88%vs. 氯吡格雷38%)。给予负荷剂量2 h后,替格瑞洛组98%患者达到>50%IPA(氯吡格雷组仅31%)。此外,无论负荷剂量后24 h内,还是 6周维持阶段,替格瑞洛抑制血小板聚集的作用均优于氯吡格雷。
避免个体差异,让ACS患者获得更为一致的抗血小板疗效
ACS患者使用抗血小板药物的另一顾虑是疗效个体差异,2010年3月,FDA发布黑框警告:由于基因多态性,部分患者可能对氯吡格雷反应低 下。氯吡格雷是一种前体药物,其药物抵抗及反应变异性主要与代谢活化过程相关。氯吡格雷须在肝细胞色素P450酶(CYP)作用下代谢为活性产物,其中 CYP 2C19发挥了主要作用,因此在CYP 2C19功能降低的患者中,氯吡格雷代谢受到严重影响,导致活性代谢产物减少,进而抑制血小板聚集作用减 弱,增加支架血栓及相关心血管事件风险。研究显示,在2146例置入药物洗脱架并接受阿司匹林+氯吡格雷治疗的韩国患者中,携带CYP 2C19*2等位 基因者较非携带者心源性死亡、心梗或支架内血栓形成发生率显著升高(2.3%vs.0.9%)。
普拉格雷虽同为前体药物,但代谢过程第一步需要血浆中的酯酶类,而第二步可经4种CYP酶中的任意一种代谢。因此,CYP 2C19功能缺失对 普拉格雷代谢及抗血小板能力影响较小。替格瑞洛则为非前体药物,无须经肝脏代谢激活,药物本身及其代谢产物均有活性,因此有效性不受肝脏CYP2C19基 因多态性影响。PLATO研究遗传学亚组分析显示,无论CYP2C19基因型为何,替格瑞洛均较氯吡格雷显著降低主要复合终点(心血管死亡、心梗、卒中) 发生率达23%;进一步比较发现, 替格瑞洛减少不同CYP2C19基因型ACS患者主要复合终点事件的作用无显著差异;但在氯吡格雷组中,与无功能缺失 (LOF)等位基因者相比,携带至少1个LOF等位基因的患者主要终点事件发生率显著较高(5.7%vs.3.8%),且携带至少1个功能增加等位基因的 患者严重出血风险显著升高(11.9%vs.9.5%)。
最新指南推荐,为ACS患者抗血小板治疗提供新选择
近期,替格瑞洛已被多项国际权威指南列为ACS抗血小板治疗Ⅰ类推荐(表2)。除药理、药代动力学和药效学的独特优势,更重要的是PLATO研 究显示,替格瑞洛可较氯吡格雷挽救更多ACS患者的生命。该研究入组18624例ACS患者(涵盖了全部类型),除研究药物外,其他治疗基于当地当时指 南,使研究更接近真实临床实践。结果证明,替格瑞洛较氯吡格雷进一步减少主要终点事件(心血管死亡、心梗、卒中)达16%,且不增加总体严重出血风险。
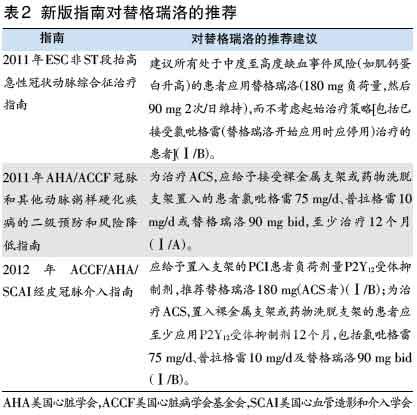
值得注意的是,个体化评估抗血小板疗效和出血风险必须考虑药物因素(药理作用机制、药物间相互作用)和患者情况。影响血小板反应性的因素众多, 何种观察性指标特异性和敏感性强均尚无定论,现仅能通过观察血栓事件作事后评估。为更有效地降低PCI围术期高血栓负荷患者风险,在严密监测下强化抗血小 板治疗方案及加强抗凝治疗对一些高危患者是必须的。临床尤须强调抗血小板治疗临床出血事件事前评估。抗血小板治疗前应用GRACE、CRUSADE评分评 估患者预后及出血风险。对一些特殊的极高危患者,欲获得最佳疗效还须注意全面风险评估,如方案设计、操作方法、并发症、辅助装置。
欧美2011-2012年新指南基于PLATO、TRITON-TIMI 38研究为新型抗血小板药物Ⅰ类推荐提示了方向。在应用此类药物减少 临床终点事件的同时,临床也须进一步评估出血风险,期待临床医生应用不久将在我国上市的新型抗血小板药物为ACS患者制定更合理的治疗方案,并在实践中进 一步验证其疗效和安全性。
(广东省人民医院 王玲 陈纪言)
上一篇:现有抗流感疫苗的有效性如何?
下一篇:评估婴儿的维生素 D 补充
频道总排行
频道本月排行
热门购物
评论排行
- 2011年临床执业医师考试实践技能真...(13)
- 腋臭手术视频(12)
- 2008年考研英语真题及参考答案(5)
- 节食挑食最伤女人的免疫系统(5)
- 核辐射的定义和单位(5)
- CKD患者Tm与IMT相关(5)
- 齐鲁医院普外科开展“喉返神经监护...(5)
- windows7激活工具WIN7 Activation v1.7(5)
- 正常微循环(5)
- 美大学性教育课来真的 男女上阵亲...(4)