经典病例:联合技术处理股骨近端感染性骨不连
2015-01-11 20:13:59 来源: 作者: 评论:0 点击:
对于骨不连病例,根据钻石学说(diamond concept)原则进行具体分析是非常重要的。机械因素——充足的固定;局部和系统的生物学因素——愈合潜能、骨折断端血供、局部软组织覆盖,这些因素中某个或某几个联合起来均能决定骨折的预后。
此外无论是在创伤伊始,还是初始的固定手术过程中甚至是随后的愈合过程中,微生物的接种均为额外的并发因素,导致骨折延迟愈合、内固定装置的松动和慢性骨髓炎的形成。
当上述因素都出现在单个骨不连患者身上时,需要在后续的手术过程中采取复杂的处置策略。通常而言,第一步是通过积极的清创手术、局部/系统应用敏感抗生素以及临时固定骨不连已达到消除感染的目的;第二部是通过外固定或内固定和植骨来固定骨折、填充骨/软组织缺损。
目前临床上对于长骨骨干骨不连的处置已有经验,但对于年轻患者的股骨近端干骺端骨不连的处置仍较缺乏经验。这篇文章,作者报告了一例结合使用大量新概念和外科技术处置干骺端骨不连的病例。
病例汇报
患者31岁健康男性,无吸烟史,于2009年11月在巴基斯坦因车祸致使右侧股骨转子间骨折、肺挫伤和严重胸部创伤。术中用4孔动力髋螺钉(DHS)固定。术后因肺功能障碍在ICU治疗2周。接受长期抗生素治疗(2代头孢菌素4周)后逐渐康复,入院5周后出院。11个月后,患者因跌倒后右髋疼痛加剧、活动变差来作者医院就诊。
回顾病史,患者无发热,右侧大腿近端有一愈合良好的手术瘢痕,右下肢短缩2cm,炎症标志物轻微上高(WBC 9.21,CPR 12,ESR 11mm)。X线片检查示:右髋骨折部位萎缩性骨不连,DHS位置良好(股骨颈扭转角良好,拉力螺钉居中,尖顶距良好)(图1)。CT扫描确定骨不连(图2)。

图1

图2
尽管没有明确病史提示患者发生术后感染,但考虑到在其他高能量损伤患者,虽手术固定良好,因感染导致骨不连、X线片也显示了萎缩性骨不连,故而怀疑患者发生了深部组织感染。
因此,对骨组织和软组织进行手术取活检。菌培养结果证实白色念珠菌(1/5样本)、凝固酶阴性葡萄球菌(1/5样本)感染。血培养:(-)、血清学检测:乙/丙肝(-),HIV(-),肺结核(-)。
保留髋关节功能是该病例进行一系列手术的基础。在彻底清创的第一步,移除所有的金属材料,桥接外固定,用PMMA抗生素骨水泥(2g万古霉素和400mg两性霉素-B)填充骨缺损(图3)。口服氟康唑 50mg 1/日和阿莫西林 1g 3/日6周,使软组织生长和炎症标志物指标正常(WBC 6.85, CPR6.1, ESR 5mm)。

图3
患者出院,到重新入院之前每周来院复查外固定和实验室检查。保持患肢不负重。制动期间,按照我院指南使用药物预防血栓(亭扎肝素4500单位皮下注射)。
2月后开始第二阶段治疗。使用“铰刀 - 冲洗 - 吸引”系统(Reamer/Irrigator/Aspirator system,RIA)从健侧股骨收集70ml自体骨,移除患侧外固定装置,刮净进针点,在牵引台上复位骨折。小心牵引以避免损坏诱导膜,使用骨刀纵向劈开并移除骨水泥。用2L生理盐水冲洗空隙和股骨骨髓腔。在生物活性膜上开窗,将混合了BMP-7的自体骨填充入骨空隙,之后用可吸收缝线连续缝合生物膜。骨折部植入12孔95度接骨板(图4),伤口逐层缝合。术后立即进行脚趾负重锻炼,术后8周逐渐右下肢负重。
术后6个月随访,患者放射检查及临床检查均显示骨折愈合,伤口愈合良好,炎症标志物指标正常(WBC 7.16,CRP<5,ESR6mm),双下肢等长,疼痛症状消失(图5)。术后42个月随访,放射检查、临床检查及生化检查均未见感染复发,未见股骨头缺血性坏死。
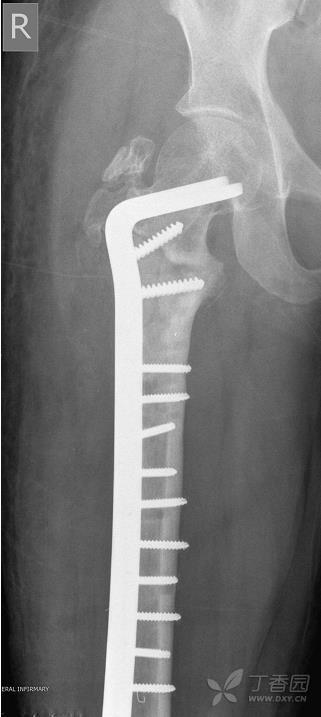
图4

图5
讨论
关于感染性骨不连的处置报道较多,虽然具体描述上因语言差异有所不同,但处理原则一致:改变局部生物环境、消灭感染、骨折愈合恢复功能。深部组织真菌感染具有挑战,因其可形成高抵抗性的生物膜,彻底铲除真菌感染需要进行彻底清创术。干骺端区域的骨缺损会产生特殊问题,会影响关节完整、稳定及功能,最终不得不进行复杂的关节置换手术或关节融合手术。
年轻患者,保持关节的结构和功能尤其重要。牵引诱导组织发生技术因其较高的针道感染率、患者耐受性差,后期导致关节僵硬、关节功能降低而无法应用。带血管植骨技术因供区发育不良及需要特殊器械和专家等因素而有限制。
这类病例的处理经验之前鲜有报道,我们对我们联合使用多种技术的策略进行汇报。这些技术包括:“诱导膜”技术(“Masquelet”技术),局部抗真菌/细菌水泥垫,“铰刀 - 冲洗 - 吸引”系统,应用混合骨移植(自体骨混合骨诱导剂BMP-7)及传统的接骨板技术。
“Masquelet”技术是一项修复骨缺损的相对较新的技术,大量的文献报道该技术用于股骨干骨折。该技术包扩两个阶段:第一阶段:先彻底清创,以PMMA骨水泥填充骨缺损区, 2~3月后骨水泥周围诱导形成血管丰富、具有生物活性的诱导膜结构。
第二阶段:取出骨水泥, 在诱导膜内植入较丰富松质骨并固定,通过诱导膜内松质骨较快成骨并皮质化来修复长段皮质骨缺损。最近4年发表了使用该技术的病例报道,基础研究也支持该项修复骨缺损技术。
PMMA水泥除了能够产生诱导膜外,也能够在局部释放高剂量的抗生素,这对于感染性骨不连非常有意义。这种投送抗细菌药物和抗真菌药物的方式已经在骨髓炎病例和假体周围感染病例中被证实有效。
RIA系统最初被发明是为解决扩髓过程中产生的二次打击和发热现象。此外,RIA系统作为一项从股骨骨髓腔收集自体骨碎片的技术得到了普及。该技术取自体骨能力(25—90cm3)相当于/略高于取前侧(5—72cm3)或后侧(25—88cm3)髂脊骨,RIA系统具有技术简单、微创、减轻供区发育不全发生率的优点。
在细胞和骨诱导蛋白含量方面,RIA系统取的骨优于髂脊骨。最近文献表明:27例股骨干骨不连患者,在诱导膜技术第二阶段使用RIA移植骨后,1年后90%患者骨折愈合。
最后,骨诱导剂在萎缩性骨不连和营养不良性骨不连的作用仍有争议。许多作者都提供随机研究和临床试验的支持证据,而其成本高,尤其是他们的重组形式,和报销的限制,减少了其普遍采用。对这类试剂在诱导膜内移植物环境中的效应及作用浓度需进行进一步研究。
目前文献中有关使用联合技术处理股骨近端干骺端感染性骨不连的案例鲜有报道。作者的经验,重申了需要充分处理生物环境和机械环境以提高骨折愈合的机会。
相关热词搜索:
上一篇:骨科频道 2014 年11 月学霸必读系列
下一篇:心得:8年骨科SCI杂志征途—从author到guest editor
频道总排行
频道本月排行
热门购物
评论排行
- 2011年临床执业医师考试实践技能真...(13)
- 腋臭手术视频(12)
- 2008年考研英语真题及参考答案(5)
- 节食挑食最伤女人的免疫系统(5)
- 核辐射的定义和单位(5)
- CKD患者Tm与IMT相关(5)
- 齐鲁医院普外科开展“喉返神经监护...(5)
- windows7激活工具WIN7 Activation v1.7(5)
- 正常微循环(5)
- 美大学性教育课来真的 男女上阵亲...(4)








