基因组学与药物反应
2013-02-13 13:14:06 来源:37度医学网 作者: 评论:0 点击:
在2003年,本杂志发表了2篇药物遗传学的综述4,5。此后,基因组科学及其在药物反应中的应用都取得了重大进展6。在此我们回顾其中一些进展,并着重于全基因组关联研究的发现。我们会介绍一些凸显与品种多样的药物有关的药物基因组学原理的例子。美国食品和药物管理局(FDA)已经改变了药物标签,并发布了有关影响药物反应的药物基因组学变异的警告,从而提出了下述2个问题:显示临床应用价值所需要的证据水平7,以及管理机构如FDA以及学术和专业学会,在评价临床药物遗传学分析中各自的作用。
心血管药物
许多药物被证实在心血管疾病的治疗和预防中有效。并不罕见,这些药物有受遗传变异影响的窄治疗指数—— 这是药物基因组学方法可提供极大临床益处的一种药物标志。抗凝药物华法林和氯吡格雷位居广泛处方的心血管药物名单的高位并且具有窄治疗指数。这些药物的药物基因组学特征说明了我们对遗传在药物疗效变异和药物不良反应危险中作用的了解的快速演变。在这两种药物的例子中,传统候选基因药物遗传学的应用已经识别出了疗效和不良反应变异的重要基因组标志物,这些观察结果后来得到了全基因组关联研究的证实。FDA对这些数据做出快速反应,重新发布了华法林的药物标签,并在氯吡格雷的药物标签上增加了一个警告框。支持这两种药物的药物遗传学检测常规使用临床实用性的资料在不断进展8-10。
在北美和大部分欧洲国家,华法林是最广泛处方使用的口服抗凝药11。尽管可以利用国际标准化比值(INR)这一普遍用于衡量华法林抗凝效果的实验室检测,但严重不良反应,包括出血和意外凝血,仍然使治疗变得复杂,从而使华法林成为最常引起急诊就诊的药物之一12,13。从化学结构上讲,华法林是一种外消旋混合物(即由2种镜像对映的同分异构体组成的混合物)。作为一种抗凝剂,S-华法林的功效是R-华法林的3~5倍,半衰期较短,并且主要由细胞色素P-450酶CYP2C9代谢11。2种常见的CYP2C9等位基因酶(参见词汇表)仅有野生型等位基因酶CYP2C9*1酶活性水平的一部分:CYP2C9*2为12%和CYP2C9*3为5%11,14。十多年以前,有研究报告,根据INR值获得低的华法林最终剂量的病人,经常携带1个或2个这两种常见的CYP2C9变异体等位基因,并在华法林治疗期间出血危险升高,大概是因为他们代谢药物的速度较慢14。这些观察结果已得到证实,
词汇表
等位基因酶:由存在于一个基因位点的遗传变异体(等位基因)决定的酶的另一种形式。
基因簇:在基因组中距离很近并且编码相似基因产物的两个或多个基因。
全基因组关联研究:一种用于遗传学研究的方法,用以寻找大量(通常有数十万)特定遗传变异(最常见于单核苷酸多态性)与特殊疾病之间的相关性。
单核苷酸多态性:在一个基因序列中的单核苷酸变异;人类基因组中变异的常见类型。
但很快明确,CYP2C9 多态性的存在并不能解释大多数华法林最终剂量的变化。
华法林的药物遗传学研究在2004年发生了极大变化,当时识别出了以华法林为基础的抗凝剂的治疗靶点,维生素K 环氧化物还原酶复合体亚单位1(VKORC1)15,16,研究显示VKORC1的单核苷酸多态性(SNPs)与达到目标INR值需要的华法林剂量相关17。在2009年,一项全基因组关联研究在大约1000例正在使用华法林的瑞典病人中寻找了数十万SNPs与华法林剂量之间的相关性。结果显示在CYP2C9和VKORC1(图1A)中及其附近有2个重要信号18。当作者通过多元回归校正消除了这些信号的影响后,他们观察到另外一个信号,意味着有另外一个细胞色素P450基因(CYP4F2)(图1B)。后续研究显示CYP4F2催化维生素K氧化19。变异的CYP4F2等位基因酶催化反应的能力降低,因此,携带CYP4F2相关遗传变异体者有可能需要增加华法林的剂量(图1C)。在一项醋硝香豆素使用(一种与华法林相关的抗凝剂)的全基因组关联研究中,CYP2C9、VKORC1和CYP4F2也被涉及20。

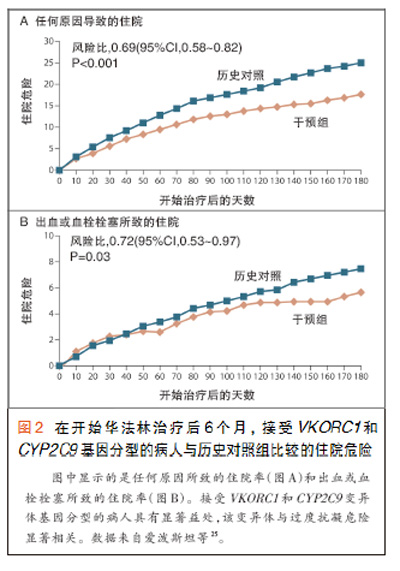
总之,CYP2C9和VKORC1基因型解释了华法林最终剂量中全部变异的大约30%~40% 21。这些观察结果提出了如下可能性:检测病人的CYP2C9和VKORC1变异有可能提供信息,从而改善当前用于指导华法林使用的临床流程。为了检验CYP2C9和VKORC1基因型检测的潜在临床应用价值,除了监测INR和常规使用临床流程之外,国际华法林药物遗传学协会最近在大约4000名不同祖先的人中研究了华法林的抗凝疗效反应,以及CYP2C9和VKORC1 的基因型数据。研究人员对应用包括年龄、性别和INR值的标准临床流程的治疗转归和使用一种包括CYP2C9和VKORC1基因型信息的流程的转归进行了比较22,得出的结论是,增加基因型信息可改善病人转归,尤其是对于需要非常高或非常低的华法林剂量的病人22。CYP4F2未被列入这个流程,但已被列入最近建立的数项流程23,24。与此结论相一致的是一项对下列两组病人进行比较的研究结果:一组约900例病人,处方医师可获得他们的CYP2C9和VKORC1遗传信息,另一组是与之相匹配的历史对照组病人,他们开始华法林治疗时没有遗传信息25。在开始华法林治疗后6个月,给处方医师提供CYP2C9和VKORC1遗传信息的病人组出血所致的住院较对照组少28%(图2)。
FDA在2010年2月修订了华法林的药物标签,提供了基因型特异性剂量范围,并且建议在处方药物时要考虑到基因型。CYP2C9和VKORC1基因分型的广泛应用,以及基于网站的工具和个人决策支持工具的发布,都促进了这种信息的临床应用。尽管如此,临床采用基因型指导华法林用药的工作仍进展缓慢,即使支持采用的证据与支持当前所用临床变量(如年龄、药物相互作用和遗传来源)的证据相似。一些观察者已经表示需要前瞻性评估这种遗传信息在华法林治疗中的价值,并且多项前瞻性临床试验正在进行中26。其他抗凝疗法也正在开发中,也许在存在与华法林疗效反应极端变化相关的基因型的病人中,有可能取代华法林27。
氯吡格雷通过与特异性血小板二磷酸腺苷(ADP)受体P2Y12不可逆地结合而抑制ADP刺激的血小板活化,从而抑制血小板聚集28,29。双重抗血小板治疗 ——氯吡格雷和阿司匹林——已经显示可降低以后发生缺血性血管事件的危险30-32。然而,氯吡格雷是一种前体药物,需要在由另一种细胞色素P-450酶CYP2C19催化的反应中代谢活化。与CYP2C9一样,CYP2C19具有常见SNP的基因多态性,从而产生了一种几乎没有酶活性的截短型蛋白产物33。多项研究已经显示,CYP2C19中引起活性缺乏的遗传变异与氯吡格雷代谢活性降低、抗血小板作用下降以及心血管事件可能性增加相关34,35。这些观察结果已经在全基因组关联研究中获得证实34。
在2010年初,FDA在氯吡格雷的处方信息中增加了一个加框警告,指出具有CYP2C19变异体(编码一种与低代谢率相关的酶)者可能需要剂量调整或使用一种不同的药物36。在这次FDA的行动之后,美国心脏学会和美国心脏病学会发表了一项联合倡议:对于具有中度或高度心血管事件危险并接受氯吡格雷治疗的病人进行CYP2C19基因分型37。这项基因检测已在美国广泛应用。然而,对其使用的热情正在消减,原因是有关携带CYP2C19变异体病人的最佳治疗尚不明确,正如来自2项大规模、随机临床试验的数据所示,在这两项研究中,在有急性冠脉综合征或心房颤动的病人中,CYP2C19基因分型对心血管事件发生率没有显著影响39,39。另一方面,最近一项对来自9项氯吡格雷药物遗传学研究(涉及9685例急性冠脉综合征或正在接受经皮冠脉介入治疗的病人)的数据进行的荟萃分析显示,CYP2C19功能降低等位基因的纯合性或杂合性与心血管原因死亡、心肌梗死或卒中的危险增高之间存在显著相关性9。当前,尚不清楚预测氯吡格雷疗效反应的基因分型是否具有临床应用价值。多项研究正在进行中,以评估在携带CYP2C19变异体等位基因的病人中进行氯吡格雷剂量调整的作用8。
用于传染病的药物
全基因组关联研究已经证实了既往研究中涉及的候选基因(导致重要临床转归)遗传变异体的特性,包括严重特应性不良反应和药物疗效变异。在后面的一系列例子中,药物基因组学研究的结果是意想不到的。
肝脏毒性反应是研究新药疗效的临床试验终止的最常见原因,大约占终止临床试验的33%,并且是上市后药物撤市的一个重要原因40。氟氯西林,一种在欧洲和澳大利亚用于治疗葡萄球菌感染的抗生素,与一种胆汁郁积性肝炎的罕见类型相关,估计的发生率大约为8.5例/10万例病人41-44。2009年报告的一项多中心全基因组关联研究分析了51例氟氯西林诱发的肝损伤病人和282名相匹配对照者的基因型45。主要组织相容性复合物中与HLA-B*5701紧密连锁的一个SNP显示与肝损伤有极强的相关性。已有研究报告,存在HLA-B*5701与对阿巴卡韦(一种用于治疗1型人类免疫缺陷病毒感染的核苷类似物)的超敏反应之间存在相关性46-48,这导致FDA修改了阿巴卡韦的标签,纳入如下一项建议:病人在开始治疗之前接受HLA-B*5701的基因分型49。罕见但严重的不良反应代表了药物在被FDA批准后撤市的一个重要原因。虽然有可能尝试重复出HLA-B*5701变异与氟氯西林诱导的肝炎之间的相关性45,但往往难以收集到足够的罕见药物不良反应病例,以应用全基因组技术。
这种情况呈现了对管理者的一种挑战。迄今,FDA通常选择在药物标签中列入与罕见严重不良事件相关的药物遗传学信息 ——即使变异体与药物反应之间的相关性没有被重复出——以此警告处方医师潜在的危险50。这种方式加重了临床医师的负担,他们要运用自己的判断力决定,在处方药物之前是否需要进行药物遗传学检测。与相关性的非重复检测相反的是为了避免不良药物遗传学反应进行的基因分型前瞻性试验。本期杂志报告了一项这种研究51,在这项研究中,研究人员观察到,在一个近5000例准备采用卡马西平治疗的台湾人样本中,没有一例史蒂文斯— 约翰逊综合征(Stevens-Johnson 综合征,重症多形性红斑、或中毒性表皮坏死松解症病例,在这个样本中,HLA-B*1502 等位基因携带者撤掉了卡马西平治疗,已有研究报告,在汉族人中HLA-B*1502 等位基因与史蒂文斯— 约翰逊综合征相关52。
涉及用于治疗传染病的药物的另一个药物基因组学例子是关于丙型肝炎病毒(HCV)慢性感染的治疗,这种感染发生于大约80%的病毒感染病人,并且是肝衰竭的一个重要原因53,54。慢性HCV感染的成功治疗涉及到持续的病毒学应答,定义为血浆中HCV RNA水平检测不到。不巧的是,仅40% ~ 50%感染基因1型HCV的病人在接受当前慢性HCV感染治疗的标准疗法(注射聚乙二醇干扰素α联合口服利巴韦林持续48周)时获得持续病毒学应答53,54。
在当前新的抗HCV-药物时代,识别出对聚乙二醇干扰素α有不同疗效反应的病人的能力很重要,因为聚乙二醇干扰素α仍然是治疗的基石,这些新药中许多是在该药基础上添加的。
最近,在3项独立的全基因组关联研究(纳入接受聚乙二醇干扰素α加利巴韦林治疗的慢性HCV感染病人)中55-57,IL28B(编码白介素-28B的基因)的变异体与药物反应之间存在相关性。在其中一项研究中,来自携带变异体等位基因(与疗效反应差相关)病人的外周血单核细胞IL28B表达水平相当低56。IL28B编码一种被认为与抑制大量病毒(包括HCV)复制相关的蛋白55-58。这个例子显示了药物基因组学全基因组关联研究是如何不仅识别出了聚乙二醇干扰素α疗效反应的生物标志物,还提供了一些知识,这些知识可被用来确定这种慢性感染的治疗方法,并且为治疗学发展选择药物靶点。
抗肿瘤药物
癌症药物基因组学领域因涉及2种基因组(病人的种系基因组和肿瘤的体细胞基因组)的事实而变得复杂。很明显,肿瘤基因组在抗肿瘤药治疗的疗效反应变异中起关键作用。突出的例子包括,在乳腺癌病人中HER2过表达或扩增和这些肿瘤对曲妥珠单抗的疗效反应59,60,以及编码表皮生长因子受体(EGFR)的基因有活化突变的非小细胞肺癌病人对EGFR拮抗剂吉非替尼的敏感性增加61,62。最近的一个例子涉及黑素瘤和编码丝氨酸-苏氨酸蛋白激酶的BRAF突变。由于一种特异性抑制剂PLX4032以突变的活化激酶为靶点,因此该药有一种药物遗传学作用,即PLX4032延长携带这种突变病人的生存期。这一临床结果是在通过对肿瘤中大量激酶基因进行测序从而发现BRAF突变的基础上得到的63,64。另一方面,编码硫代嘌呤甲基转移酶(TPMT)基因的种系SNPs可引起对巯嘌呤的敏感性增加(因为代谢降低)1,4,5,而种系DNA 中UGT1A1启动子中的大量TA双核苷酸重复(序列)可增加伊利替康的毒性反应(也是因为代谢下降低)1,65。现在已经有了许多与抗癌药物配对的药物遗传学检测的例子,这些药物已被视为常规肿瘤治疗的一部分(表1,见4月7日E7版)。肿瘤基因组和病人种系基因组中临床相关的药物基因组学变异都可影响抗肿瘤治疗疗效反应的事实如图3所示,该图以吉非替尼和伊立替康为例。
上一篇:炎症期间的嘌呤能信号转导
下一篇:美国假体关节感染诊断及治疗指南
频道总排行
频道本月排行
热门购物
评论排行
- 2011年临床执业医师考试实践技能真...(13)
- 腋臭手术视频(12)
- 2008年考研英语真题及参考答案(5)
- 节食挑食最伤女人的免疫系统(5)
- 核辐射的定义和单位(5)
- CKD患者Tm与IMT相关(5)
- 齐鲁医院普外科开展“喉返神经监护...(5)
- windows7激活工具WIN7 Activation v1.7(5)
- 正常微循环(5)
- 美大学性教育课来真的 男女上阵亲...(4)