生物标志物综述—药物研发的催化剂
2011-05-02 20:20:05 来源: 作者: 评论:0 点击:
物都以基因表达水平为基矗研究人员最近越来越意识到,表观遗传学改变——无论是DNA甲基化还是组蛋白修饰——都在个体发育和疾病发生过程中扮演着非常关键的角色。
目前发现的大部分表观遗传学生物标志物都集中于DNA超甲基化。DNA超甲基化是肿瘤形成中最常见的现象,超甲基化可以通过对基因启动子进行甲基化修饰,从而沉默肿瘤抑制因子及肿瘤细胞周期调控基因。
印第安纳大学医学院(Indiana University School of Medicine)细胞生理学教授Kenneth Nephew是研究乳腺癌和卵巢癌生物标志物的表观遗传学相关变化的科学家。他表示,这些表观遗传学变化之所以可以作为一类优秀的疾病生物标志物,有下列 三个原因:稳定、常见、可获得信号。此外,这些标志还易于检测。当肿瘤细胞死亡后,其细胞内的DNA便进入血液循环。因此,研究人员致力于找出在血液、尿 液、粪便和痰液中检测甲基化DNA的方法,从而更早地诊断疾病。
Art Petronis是一名来自位于多伦多的成瘾性及精神卫生中心(Centre for Addiction and Mental Health)的研究人员。他认为,该检测方法与单核苷酸多态性及基因表达生物标志物检测十分相似,都是基于芯片检测的方法。区别只在于需要采用“嵌合 式”芯片进行甲基化检测。
“嵌合式”芯片会覆盖整个基因组(或基因组的绝大部分位点),而不是集中于蛋白质编码区域或多态性DNA位点。 Petronis采用了两种芯片来寻找复杂的非孟德尔式遗传疾病的表观遗传学标志:一个是包括12000个CpG岛在内的芯片;另一个是 Affymetrix公司的GeneChip Human Tiling 2.0R 芯片系列。该产品密度更大,以35bp长度的探针覆盖了整个人类基因组。芯片系列由七个芯片组成。
Petronis指出另外一个区别是,他们需要富集高密度或低密度甲基胞嘧啶的片段,然后检测这些片段。
进行上述步骤通常主要有两个方法,其一基于甲基化DNA具有不同限制性内切酶敏感性;其二则是采用重亚硫酸盐将甲基胞嘧啶转换为尿嘧啶。
Peter Laird是南加利福尼亚大学(University of Southern California)表观基因组中心的主任。他在寻找结肠直肠癌分类和卵巢癌检测的生物标志物的研究中,采用了两种重亚硫酸盐转换策略。
Larid首先采用的是Illumina的 Infinium检测系统——一种可以对12个不同样本中多达27000个CpG岛进行检测的方法。然后,他又采用更为灵敏的名为MethyLight的 技术,从而验证候选标志。MethyLight以Applied Biosystems的TaqMan 定量PCR技术为基础,它具有极高的灵敏度。
Larid 认为,借助MethyLight,他们可以有效检出仅占总体0.1%的DNA。而传统的表达谱、修饰谱技术,如芯片检测,都无法达到这一灵敏度。
西北大学(Northwestern University)副教授Victor Levenson认为,采用重硫酸盐修饰的方法进行研究是表观遗传学领域的一项突破。在那之前,想要鉴定出序列特异性的表观遗传学修饰是非常困难的。
但他同时指出,技术突破也要付出代价。首先,重硫酸盐修饰转变碱基通常会破坏85%到95%的DNA,从而产生潜在的偏差。而以剩余DNA为模板进行PCR则是十分困难的,原因之一在于两条链不再互补;其二在于原本由四类碱基组成的序列变成了只包含三类碱基的序列。
因此,Levenson公司采用基于限制性内切酶的方法寻找生物标志物。此外,Epigenomics公司采用名为差异甲基化杂交(DMH)的方法(如图1)。
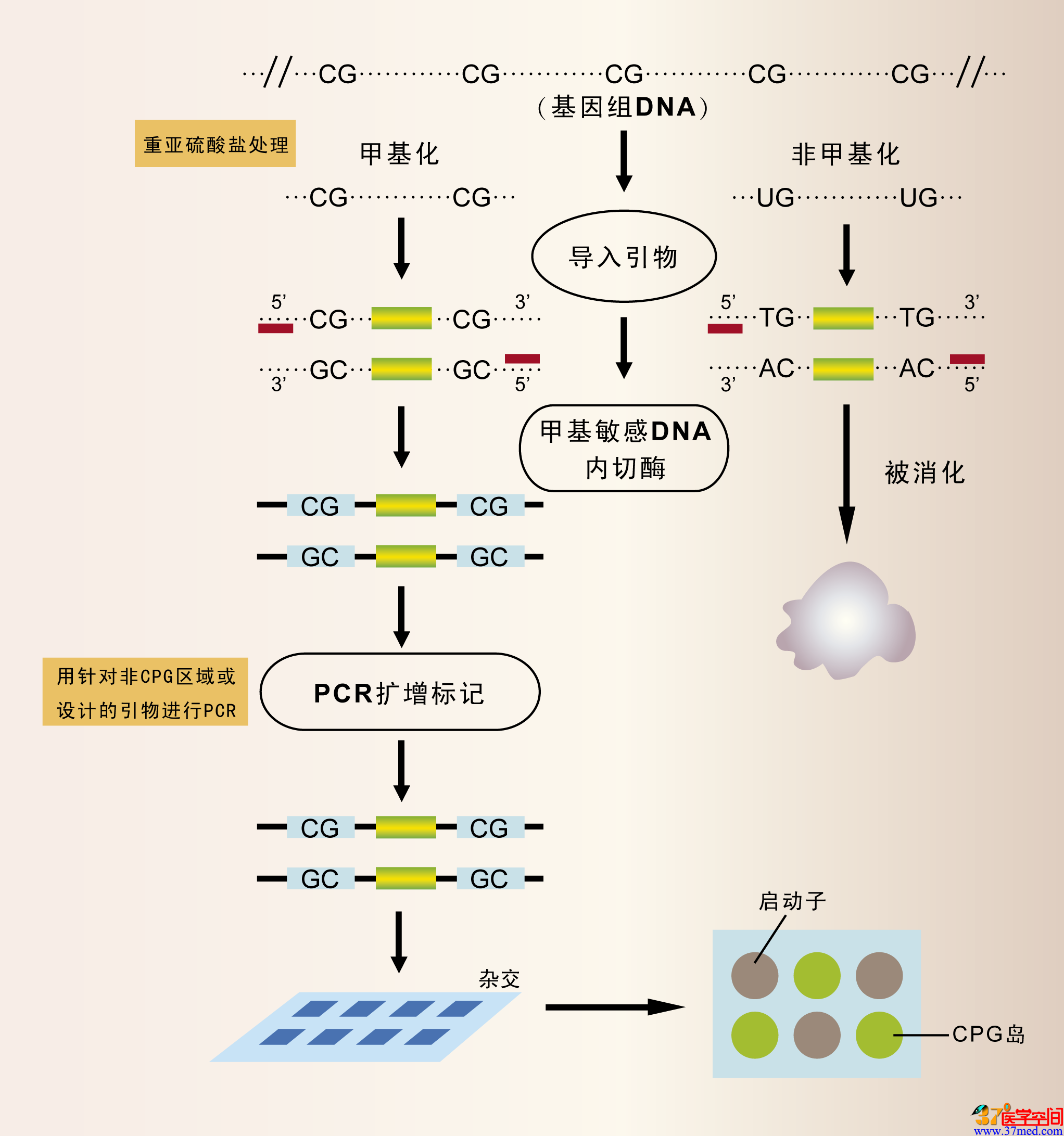
图1 DMH步骤包括将基因组DNA打成片段,使引物与各片段末端结合,然后用甲基化敏感性酶进行消化。其中,经过甲基化修饰的DNA不会被酶消化,而非甲基化的DNA则被消化分解。因此,那些非甲基化DNA便不会再继续参与包括片段扩增等后续步骤,及采用覆盖50000个基因组片段的Affymetrix芯片进行检测的过程,其中50000个片段中大部分是启动子和CpG岛。
igenomics公司副总裁Achim Plum认为:“上述芯片的好处在于我们已经知道哪些区域应该重点观察。因此,那些被探针覆盖的片段是我们在自身所具有的认识和经验上通过高度筛选而获得的。”
Plum还谈到,公司已经使用DMH方法进行一项肺癌诊断检测技术的研发工作。他说:“这一项目从生物标志物的发 现,到最终的临床验证的完成耗时不到一年。通过检测血液中的生物标志物,可以对肺癌进行检测诊断,灵敏度达到69%,特异性达到 91%。”Epigenomics公司还与Abbott Molecular合作,建立了一种结肠直肠癌筛选检测方法,该检测是以血液中的甲基化Septin-9 DNA为生物标志物的。Orion Genomics采取了相似的策略,他们采用的是MethylScope检测法,该方法由冷泉港实验室的Robert Martienssen建立(图2)。
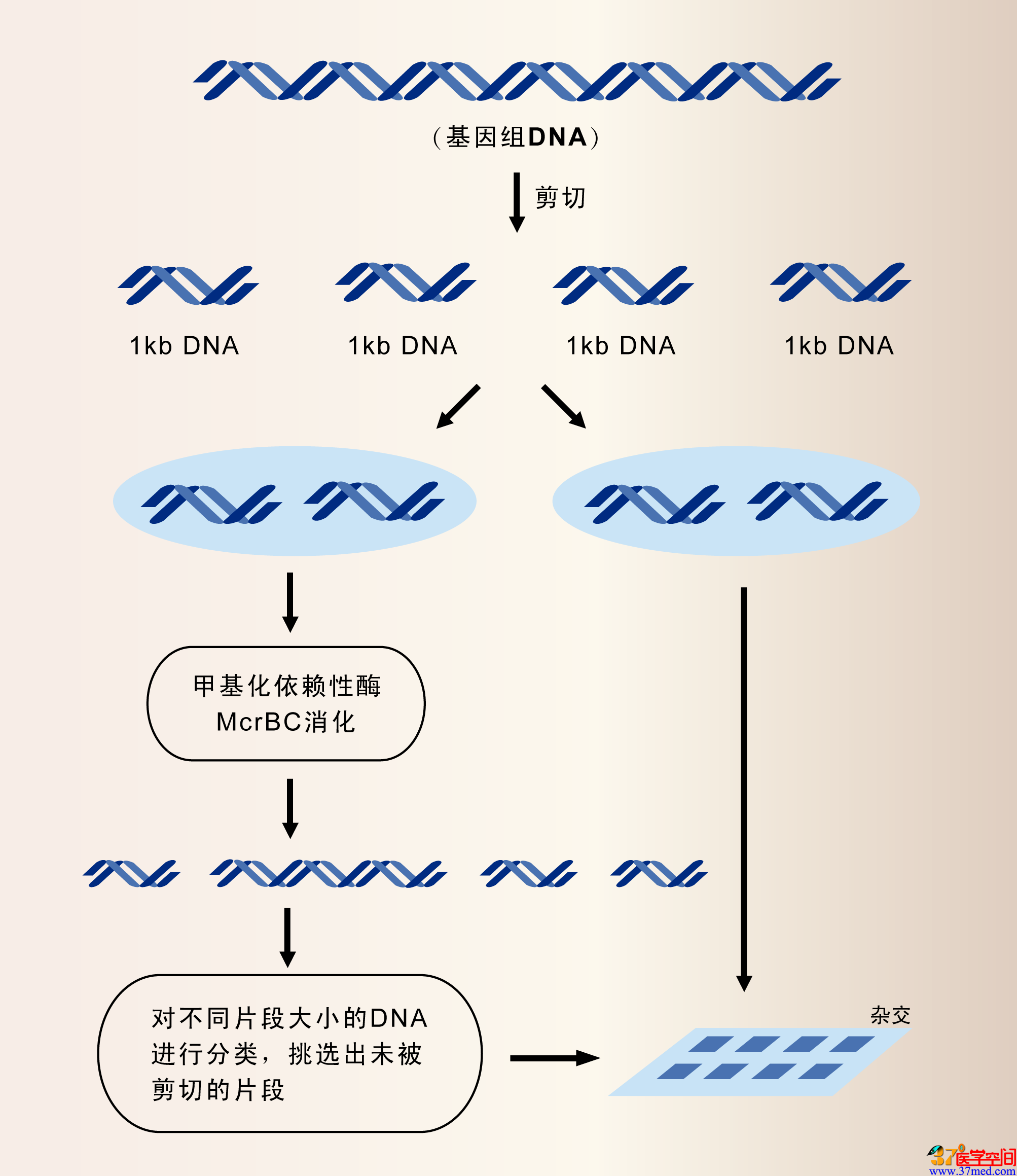
图2 该方法中,首先将基因组DNA剪切成为1kb长度左右的片段,将这些片段分为两个部分,其中一部分用甲基化依赖性酶McrBC消化,按照片段大小对消化产物进行分类,挑选出没有被剪切的片段,然后将两部分片段在由210万个寡核苷酸组成的阵列上进行杂交,该阵列由Nimblegen出品。
Orion的CEO Nathan Lakey说:“如果能够找到具有诊断意义的生物标志物,哪怕只是一个区域的序列也能够为我们提供丰富的信息。实验中,我们发现了一个单个位点的表观遗传 学改变,它可以将乳腺癌组织和非肿瘤组织鉴别开来,灵敏度和特异性分别达到90%和96%。”
阵列应用范围
哈佛及麻省理工学院Broad研究所(Broad Institute of Harvard and MIT)的Bradley Bernstein建立了一种组蛋白修饰的全基因组筛选法,从而不再需要采用DNA阵列进行相关研究。
“ChIP-Seq”法是将染色质免疫沉淀和Illumina公司的新一代测序技术相结合的产物,由Solexa推出。ChIP-on-chip法采用全 基因组微阵列芯片对ChIP数据进行检测。与此类似,ChIP-Seq法也是在全基因组的视角上对染色质改变进行检测的。Bernstein说:“两种方 法的区别在于,ChIP-on-chip法是以不同的荧光强度为基础进行检测,而ChIP-Seq则是对某一基因组片段被检测到的次数进行计数。”
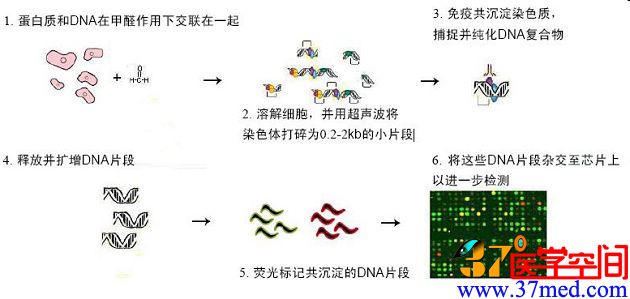
图 ChIP-chip技术流程
他接下来解释说:“ChIP-on-chip的结果输出的是模拟信号,而ChIP-Seq是数字信号输出。”
去年八月,Bernstein与人合作进行了一项研究,采用ChIP-Seq对小鼠胚胎干细胞、神经祖细胞、胚胎成纤维细胞基因组中的组蛋白修饰进行鉴别检测。他说:“所获得数据使我们对细胞的发生过程、目前状态及最终方向有了深入了解。”
发表于2月17日《自然》(Nature)杂志的一项研究,描述了检测甲基化DNA的类似方法,该方法可以检测出单 碱基的甲基化DNA,方法名叫BS-Seq。BS-Seq是将Solexa的测序技术和重硫酸盐转变法结合;研究人员利用该方法对拟南芥 (Arabidopsis)基因组内所有可能的甲基化位点中约93%的位点进行了鉴别。
一旦美国国立卫生研究院(NIH)投入达1亿9千万美元的表观基因组项目启动,上述研究成果将具有不可估量的价值。
Bernstein也承认DNA甲基化与组蛋白修饰相比,在生物标志物研究中具有更大的价值。这是因为,肿瘤细胞释放DNA进入血液循环后,并不会同时释放完整的染色质,因此,组蛋白标记只能在未受损细胞和组织中进行检测。
他说:“组蛋白和染色质中包含着更为丰富的信息,但是它们也更难测定。”
Stephen Baylin是马里兰州Baltimore市Sidney Kimmel综合性肿瘤中心(Sidney Kimmel Comprehensive Cancer Center)的研究人员,他表示,无论怎样,这些研究都将是通往个性化治疗道路上重要的一步。
4.2 寻找具有诊断意义的蛋白生物标志物

当蛋白质组学研究人员开始采用高通量技术不断发现疾病生物标志物时,基础科学领域的科学家和仪器设备制造商却仍然致力于证明这一新型检测方法的可靠性。
1896年,约翰?霍普金斯医院(John Hopkins Hospital)的管理层购买了一套特殊的设备,用来培养微生物、检查组织标本以及分析体液样品。他们将这套设备塞进一间只有12平方英尺的小房里。建立这间实验室的所有花费仅为50美元。
1896年,约翰?霍普金斯医院(John Hopkins Hospital)的管理层购买了一套特殊的设备,用来培养微生物、检查组织标本以及分析体液样品。他们将这套设备塞进一间只有12平方英尺的小房里。建立这间实验室的所有花费仅为50美元。
尽管建立一间临床实验室需要不断增添昂贵的设备和受过专业培训的技术人员,但实验室所带来的好处还是远远超过了这些花费。由于临床实验室的存在,医生可以确切知道病人的问题所在,而且得以尽可能地在疾病早期发现问题。
然而,像许多技术革新一样,临床实验检测同样很快到达了发展的平台期。即使在今天,还很难确诊多种致死性疾病。当然,如果病人罹患的是白喉或甲 状腺疾病,医护人员很容易就能诊断出来;但是,如果病人不幸罹患癌症或阿尔茨海默氏病,要想进行准确的早期诊断,就十分困难了,大部分这类疾病都是在晚期 才获得确诊。
目前,在新型分子实验设备、精密技术的不断涌现以及蛋白质组学飞速发展的促进下,部分研究人员正致力于采用蛋白生物标志物解决上述棘手问题。 从理论上说,疾病早期,机体细胞内各种蛋白的表达水平就会发生一定改变,检测蛋白表达谱的改变可以更加快速和准确地诊断疾病。但是把这种理论转变为现实可 操作的检测项目并非容易的事情,不过最近所取得的工作成果证明,至少这种转变还是有可能的。
“更少”可能是“更多”

加拿大蒙特利尔大学(University of Montreal)药学院的副教授Martin Latterich指出,新型检测策略与以往临床实验所采用的策略有着明显的不同。传统方法侧重于病理机制,所以检测项目也以其机制为基础。随着高通量技 术的来临,部分研究人员开始通过将病人全蛋白组与正常人的全蛋白组进行比较,从而诊断相应疾病。
如上所述,既然从如此宏观的角度检测疾病,科研人员当然会发现一些直接参与致病过程的蛋白变化。但此外,他们还发现了许多替代性生物标志物 (surrogate biomarker)。对高通量生物标志物分子检测技术持批评态度的人认为这种“撒大网”式的检测方法缺乏传统机制研究中所具有的科学严谨性。 Latterich对此作出了回应,他在2005年发表的一篇社论(Proteome Sci. 3:8, October 28, 2005)中阐述了自己的观点:机制研究与高通量研究互补,生物学家应该认识到,在有些时候,“少即是多”的道理。
马里兰州国立癌症研究所(NCI)蛋白质组学和分析技术实验室主任SAIC-Frederick表示,现代生物标志物分子筛选技术的另一个问题是大量假阳性的存在。他指出,在进行相关实验时,人们确实处于盲目的状态,不知道会获得何种生物标志物。
实际上,许多研究生物标志物的研究人员都提到验证是该 领域的最大难题,即如何从现有的大量候

选生物标志物中缩小范围进一步筛选,最终获得少量几个真正有用的生物标志物的过程。对于Veenstra来说,他的实验室着重研究前列腺癌、乳腺癌和卵巢癌的生物标志物,第一个问题就是如何从数百个表达发生变化的蛋白中初步筛选出真正有价值、值得继续追踪的几个分子。
即使排除了干扰分子,研究人员还必须开发更加有效且更具重复性的实验方法。Veenstra指出,验证过程确实需要多部门协作,比如发现分子 的实验室和重点研究抗体或酶联免疫吸附(ELISA)的实验室之间就需要有效合作。ELISA是临床实验室中检测蛋白的标准方法,但进行一项新型 ELISA实验可能需要数月时间。研究人员要验证更多的候选生物标志物,就必须进行更加多的实验。
为了更好地突破这一瓶颈,实验仪器制造商开始改良沿用了数十年的旧式ELISA方法。Perkin Elmer的以独有的抗体结合磁珠系统(antibody-binding bead system)为基础的AlphaLISA系统有着非常好的应用前景。AlphaLISA系统去掉了标准ELISA中严格的洗涤步骤。此外,整个检测过程 更容易实现自动化程序。其中,后一项优势将会是一个非常好的卖点,因为基于多种生物标志物筛选的检测项目,开始逐步进入原本已经超负荷运转的临床实验室。
实际上,第一个基于蛋白质组学的临床检验项目即将出现。制药公司和临床检验公司都对此项目表示了高度的热情,即便验证过程和实验过程将会非常昂 贵,他们仍然愿意投资这个新一代的项目——生物标志物。获悉NCI的研究人员发现蛋白表达谱与卵巢癌的预后有
上一篇:三级综合医院评审标准
下一篇:神经病理性疼痛
频道总排行
频道本月排行
热门购物
评论排行
- 2011年临床执业医师考试实践技能真...(13)
- 腋臭手术视频(12)
- 2008年考研英语真题及参考答案(5)
- 节食挑食最伤女人的免疫系统(5)
- 核辐射的定义和单位(5)
- CKD患者Tm与IMT相关(5)
- 齐鲁医院普外科开展“喉返神经监护...(5)
- windows7激活工具WIN7 Activation v1.7(5)
- 正常微循环(5)
- 美大学性教育课来真的 男女上阵亲...(4)