对抗COPD:治疗新靶点和新思路
2009-05-26 20:37:00 来源: 作者: 评论:0 点击:
由于目前对慢性阻塞性肺疾病(COPD)发病机制的认识仍很模糊,COPD药物治疗一直缺乏突破性进展,现今没有任何药物被证实能阻止疾病进展或降低患者死亡率。《胸》[Chest 2008, 134:1278]杂志近日综述了COPD的治疗新靶点和新药物,尽管它们“小荷才露尖尖角”,但对于一直在暗夜中摸索的研究者,它们可能是远方的点点曙光。我们选编其中精华内容,并特邀中国医学科学院北京协和医院蔡柏蔷教授作评述,以飨读者。
新型支气管扩张剂
长效吸入型支气管扩张剂是治疗COPD的主要手段,改善COPD治疗的一条“捷径”是改良现有的支气管扩张剂。几种每日使用一次的吸入型β2受体激动剂如茚达特罗(indacaterol)和卡莫特罗(carmoterol)正处于临床研发阶段。茚达特罗是一种有效的人小气道扩张剂,对COPD患者的支气管扩张作用超过24小时,起效迅速,未出现明显副作用或患者耐药现象。
每日使用一次的吸入型抗胆碱能药物噻托溴铵是COPD治疗的重要进展。正在开发的长效吸入型毒蕈碱拮抗剂有阿地溴铵(aclidinium bromide)和格隆溴铵(glycopyrrolate)。长效β2受体激动剂与长效吸入型毒蕈碱拮抗剂的支气管扩张效应可互相叠加,研究者正在开发二者的联合吸入制剂和将二者偶联的单分子药物。
开发全新作用机制的支气管扩张药物非常困难。在体外试验中,钾通道开放剂能舒张人气道,但对哮喘患者却未显示出疗效,原因是其强效扩血管作用限制了给药剂量。人们曾试图开发抑制气道平滑肌收缩机制的药物如Rho激酶抑制剂、肌球蛋白轻链激酶抑制剂和直接抑制肌球蛋白的药物。为减弱扩血管作用,需吸入给药。
蛋白酶拮抗剂
在COPD患者中,消化弹性蛋白及其他结构蛋白的蛋白酶与保护性抗蛋白酶失衡。这提示,抑制蛋白水解酶或增加内源性抗蛋白酶可能有益,至少在理论上能防止肺气肿发展。
事实上,多种蛋白酶可能与COPD发病有关,仅阻断一种也许不会有明显作用。内源抗蛋白酶类可以重组体方式给药或通过病毒载体基因导入,但这些方法可能效价比偏低。
一种更有前景的方法是针对蛋白酶、特别是具有弹性蛋白水解活性的酶,开发小分子抑制剂。中性粒细胞弹性蛋白酶抑制剂已经问世,但在临床试验中未显示出疗效。
具有弹性蛋白水解活性的金属基质蛋白酶(MMP)也是药物开发的靶点,巨噬细胞、中性粒细胞和上皮细胞释放的MMP-9似乎是其中最主要的酶。非选择性MMP抑制剂如马力马司他(marimastat)则有明显副作用,提示可能需要开发亚型选择性药物,或者采用吸入途径给药。
研究证实,AZ11557272(一种MMP-9/MMP-12双重抑制剂)能防止暴露于烟草烟雾超过6个月的豚鼠发生肺气肿和小气道增厚,但其临床开发却被不明原因地中止了。

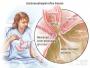
图 COPD病理生理机制、治疗靶点及方案
广谱抗炎药物
PDE4抑制剂
磷酸二酯酶(PDE)4是中性粒细胞、T细胞和巨噬细胞表达的最主要PDE。
罗氟司特(roflumilast)是一种选择性PDE4抑制剂。一项在吸烟小鼠COPD模型中进行的研究表明,罗氟司特能抑制肺炎症和肺气肿。
COPD患者口服罗氟司特4周以上可明显减少痰内中性粒细胞数量和CXCL8浓度,服用6或12个月以上可轻度改善肺功能,但不能显著减少病情急性加重或改善生活质量,原因可能是药物副作用限制了其使用剂量。
吸入给药可克服上述难题,但迄今为止的两种吸入性PDE4抑制剂尽管患者耐受性良好,但无明显疗效。
另一种方法是开发亚型选择性抑制剂。一种选择性PDE7抑制剂单用时只有很弱的抗炎作用,但能增强PDE4抑制剂的抗炎作用,或许可以开发二者的联合制剂。
p38 MAPK 抑制剂
有丝分裂原激活的蛋白激酶(MAPK)在慢性炎症中发挥重要作用,几条酶联通路已被阐明,p38 MAPK通路就是其中一种。它在细胞应激状态下被激活,调控炎症因子表达。
在COPD患者肺泡巨噬细胞中,p38 MAPK处于激活状态。SD-282是p38-α 亚型的一种强效小分子抑制剂,在体外能有效抑制人肺巨噬细胞释放TNF-α,并能有效抑制吸烟COPD小鼠模型的炎症。几种已进入临床试验的p38 MAPK 抑制剂暴露出副反应和毒性等问题,可能需吸入给药。
所有p38 MAPK 抑制剂都针对p38-α 和(或)p38-β亚型。p38-γ 和 p38-δ 亚型的功能尚未明确。p38-δ亚型在人肺泡巨噬细胞中表达水平很高,但作用不明。
NF-κB抑制剂
核因子(NF)-κB调节CXCL8及其他趋化因子、TNF-α及其他炎症细胞因子、MMP9的表达。COPD患者巨噬细胞和上皮细胞中NF-κB处于被激活状态,在多条可能抑制NF-κB的途径中,NF-κB激酶(IKK)2的小分子抑制物可能最有前景。
有一种IKK2抑制剂在一些脂多糖诱导的COPD动物模型中有效,但在其他(如中性粒细胞弹性蛋白酶灌注诱导者)模型中却无效,表明其机制可能很复杂。多种IKK2抑制剂现正处于开发阶段,尚未用于COPD患者。对于长期抑制NF-κB是否导致免疫功能受损,研究者仍存疑虑。
PI3K抑制剂
磷脂酰肌醇3激酶(PI3K)通过脂类第二信使调节细胞活动,包括固有和适应性免疫反应。
PI3K-γ亚型参与中性粒细胞的募集和活化,敲除PI3K-γ基因导致中性粒细胞迁移和活化能力下降、T淋巴细胞和巨噬细胞功能受损,因此,PI3K-γ抑制剂可能有抗炎症作用。
PI3K-δ也与炎症基因表达有关,目前正在开发几种PI3K-δ或混合性PI3K-γ/δ抑制剂。
PPAR激活剂
过氧化物酶增殖物激活受体(PPAR)是一类配体激活的核激素受体,属于类固醇受体超家族,已确认的三种亚型PPAR-α、PPAR-γ和 PPAR-δ表达很广泛。
研究表明PPAR-α 和 PPAR-δ激活可能有抗炎和免疫调节作用。PPAR-γ激动剂如曲格列酮(troglitazone)和罗格列酮(rosiglitazone)能抑制单核细胞释放细胞因子,并诱导T细胞凋亡,提示它们可能有抗COPD炎症作用。
COPD患者骨骼肌中PPAR-α表达下调,且与肌无力有关,提示PPAR-α激动剂如氯苯丁酯(clofibrate)可能有助于治疗重症患者的肌无力。
炎症介质拮抗剂
脂质拮抗剂
COPD患者痰液和支气管肺泡灌洗液中白三烯B4 (LTB4)含量增加,LTB4对中性粒细胞和淋巴细胞有趋化作用。
目前已有几种针对LTB4主要受体——LTB4受体1(BLT1)的拮抗剂,但将其应用于COPD患者的临床研究只得到阴性结果。理论上讲,5-脂氧合酶抑制剂能通过阻断内源性LTB 4产生而对COPD患者有益,但开发安全高效的5-脂氧合酶抑制剂却很困难。
细胞因子抑制剂
肿瘤坏死因子(TNF)-α是COPD的一种关键介质。然而,使用对类风湿关节炎和哮喘患者有效剂量的英夫利西(抗TNF-α单抗)却并未给COPD患者带来临床获益。
值得特别关注的是,研究提示接受抗TNF治疗的COPD患者发生呼吸道癌症和严重肺部感染的风险升高。
目前研究的其他细胞因子靶点还包括白介素(IL)-1β、IL-6和IL-17。IL-6受体抗体tocilizumab是一种强效IL-6抑制剂,能有效治疗类风湿关节炎,但尚未在COPD患者中进行研究。
趋化因子拮抗剂
研究者对于小分子的趋化因子受体拮抗剂怀有浓厚兴趣。
一种CXC配体(CXCL)8(即IL-8)的阻断性抗体能轻微改善COPD患者的呼吸困难症状,其他CXC趋化因子如CXCL1(GRO-α)和CXCL5(表皮衍生中性粒细胞诱导因子-78)在COPD患者中也增加,且与CXCL8作用相似。
CXCL8、CXCL1和CXCL5通过共同受体——CXC受体(CXCR) 2对中性粒细胞和单核细胞产生趋化作用。
最近研究表明,一种CXCR1/2 拮抗剂(ADZ8309)能抑制健康志愿者吸入内毒素后出现的肺内中性粒细胞炎症。其口服给药途径对于COPD患者可能是一种特殊的优势。
CXCR3的配体CXCL9、CXCL10和CXCL11在COPD患者体内浓度均升高,且表达CXCR3的T细胞数量也增加,因此CXCR3可能成为另一个药物靶点。CXCR3拮抗剂目前尚未在COPD患者中进行研究。
COPD患者体内CCL5[即调节正常T细胞表达和分泌因子(RANTES)]水平也升高。CCR5拮抗剂如马拉韦罗(maraviroc)目前已被用于治疗艾滋病,也有望在COPD患者中进行检测。
TGF-β抑制剂
研究证实,小气道纤维化是COPD患者一秒钟用力呼气容积(FEV1)和活动能力进行性下降的主要原因之一,转化生长因子(TGF)-β可能在其中起关键作用。
在氧化应激状态下或患者吸烟时,TGF-β可被激活。COPD患者小气道内TGF-β相关基因表达上调。TGF-β受体酪氨酸激酶(激动素受体样激酶5)的小分子抑制剂如SD-280已经问世。并在一种哮喘模型中被证实能抑制气道纤维化。
然而,TGF-β对维持调节型T淋巴细胞水平有重要作用,长期TGF-β抑制可能产生副作用。鉴于TGF-β很多功能是通过结缔组织生长因子介导的,抑制该因子或其受体可能是一条同样有效而更安全的途径。
肺再生
维A酸
维A酸在肺脏发育过程中增加肺泡分隔,在成年大鼠和小鼠中能逆转弹性蛋白酶处理导致的组织学和生理学变化,但在其他物种中尚未证实这种作用。人类肺泡形成在大约6岁时就已停止,因此研究者对于肺气肿是否可逆仍存争议。
一项临床研究使用全反式维A酸和9-顺式维A酸治疗肺气肿患者6个月之后,临床指标、患者健康状态或CT扫描密度未显示出任何改善。
干细胞
COPD患者气道阻塞的主要原因之一在于肺实质蛋白水解破坏导致弹性回缩力丢失,仅靠药物治疗很难逆转这一现象。
研究证实人胚胎干细胞被转化成肺泡Ⅱ型上皮细胞,后者具有修复损伤肺泡的能力。成人骨髓来源的干细胞可能也适合肺部定植,特别在经维A酸或粒细胞-巨噬细胞集落刺激因子增强处理之后更宜定植。
然而,人们对使用干细胞修复肺损伤还有一些顾虑。首先,如何把这些细胞移植到肺泡或许在技术上是个问题,并且可能有出现癌症或畸胎瘤的风险。肺是一种复杂的器官,它可能需要内皮和肺泡细胞一同生长来修复损伤。
干细胞治疗流程示意图
逆转皮质类固醇抵抗
对于延缓COPD进展,即使大剂量皮质类固醇也收效甚微,这可能是由氧化和硝化应激导致组蛋白去乙酰化酶2(HDAC2)减少,使皮质类固醇受体乙酰化程度增加,阻止受体抑制NF-κB驱动的炎症。因此,通过提高HDAC2表达和活性来逆转皮质类固醇抵抗可能是一种新的治疗策略。
茶碱
口服低剂量茶碱可增加COPD患者肺泡巨噬细胞中HDAC2表达,继而可能恢复对皮质类固醇的反应性。
茶碱作用的分子机制似乎并不依赖于PDE抑制,这可能有助于探索新型治疗手段,以此重建对皮质类固醇的反应性,并避免茶碱本身的副作用和药物间相互作用。
抗氧化剂
COPD患者体内氧化压力增加,在病情急性加重时更明显。反应性氧衍生物参与了该病理过程。氧化应激抑制HDAC2活性和表达,从而降低了患者对皮质类固醇的反应性,而抗氧化剂有可能逆转皮质类固醇抵抗。
遗憾的是,目前基于谷胱甘肽的抗氧化剂相对较弱,且会被氧化应激灭活,因此需要新的更强更稳定的抗氧化剂,比如超氧化物歧化酶类似物和烟酰胺腺嘌呤二核苷酸磷酸氢氧化酶抑制剂。
大环内酯类
大环内酯类药物似乎是通过抑制NF-κB和其他转录因子来抑制炎症,这种抗炎症作用可能与其抗生素作用无关。最近发现一种非抗生素类大环内酯药物(EM-703)可增加HDAC2活性,逆转氧化应激所致的皮质类固醇抵抗。目前多种非抗生素类大环内酯抗炎药物正在研发中。
新型支气管扩张剂
长效吸入型支气管扩张剂是治疗COPD的主要手段,改善COPD治疗的一条“捷径”是改良现有的支气管扩张剂。几种每日使用一次的吸入型β2受体激动剂如茚达特罗(indacaterol)和卡莫特罗(carmoterol)正处于临床研发阶段。茚达特罗是一种有效的人小气道扩张剂,对COPD患者的支气管扩张作用超过24小时,起效迅速,未出现明显副作用或患者耐药现象。
每日使用一次的吸入型抗胆碱能药物噻托溴铵是COPD治疗的重要进展。正在开发的长效吸入型毒蕈碱拮抗剂有阿地溴铵(aclidinium bromide)和格隆溴铵(glycopyrrolate)。长效β2受体激动剂与长效吸入型毒蕈碱拮抗剂的支气管扩张效应可互相叠加,研究者正在开发二者的联合吸入制剂和将二者偶联的单分子药物。
开发全新作用机制的支气管扩张药物非常困难。在体外试验中,钾通道开放剂能舒张人气道,但对哮喘患者却未显示出疗效,原因是其强效扩血管作用限制了给药剂量。人们曾试图开发抑制气道平滑肌收缩机制的药物如Rho激酶抑制剂、肌球蛋白轻链激酶抑制剂和直接抑制肌球蛋白的药物。为减弱扩血管作用,需吸入给药。
蛋白酶拮抗剂
在COPD患者中,消化弹性蛋白及其他结构蛋白的蛋白酶与保护性抗蛋白酶失衡。这提示,抑制蛋白水解酶或增加内源性抗蛋白酶可能有益,至少在理论上能防止肺气肿发展。
事实上,多种蛋白酶可能与COPD发病有关,仅阻断一种也许不会有明显作用。内源抗蛋白酶类可以重组体方式给药或通过病毒载体基因导入,但这些方法可能效价比偏低。
一种更有前景的方法是针对蛋白酶、特别是具有弹性蛋白水解活性的酶,开发小分子抑制剂。中性粒细胞弹性蛋白酶抑制剂已经问世,但在临床试验中未显示出疗效。
具有弹性蛋白水解活性的金属基质蛋白酶(MMP)也是药物开发的靶点,巨噬细胞、中性粒细胞和上皮细胞释放的MMP-9似乎是其中最主要的酶。非选择性MMP抑制剂如马力马司他(marimastat)则有明显副作用,提示可能需要开发亚型选择性药物,或者采用吸入途径给药。
研究证实,AZ11557272(一种MMP-9/MMP-12双重抑制剂)能防止暴露于烟草烟雾超过6个月的豚鼠发生肺气肿和小气道增厚,但其临床开发却被不明原因地中止了。

图 COPD病理生理机制、治疗靶点及方案
广谱抗炎药物
PDE4抑制剂
磷酸二酯酶(PDE)4是中性粒细胞、T细胞和巨噬细胞表达的最主要PDE。
罗氟司特(roflumilast)是一种选择性PDE4抑制剂。一项在吸烟小鼠COPD模型中进行的研究表明,罗氟司特能抑制肺炎症和肺气肿。
COPD患者口服罗氟司特4周以上可明显减少痰内中性粒细胞数量和CXCL8浓度,服用6或12个月以上可轻度改善肺功能,但不能显著减少病情急性加重或改善生活质量,原因可能是药物副作用限制了其使用剂量。
吸入给药可克服上述难题,但迄今为止的两种吸入性PDE4抑制剂尽管患者耐受性良好,但无明显疗效。
另一种方法是开发亚型选择性抑制剂。一种选择性PDE7抑制剂单用时只有很弱的抗炎作用,但能增强PDE4抑制剂的抗炎作用,或许可以开发二者的联合制剂。
p38 MAPK 抑制剂
有丝分裂原激活的蛋白激酶(MAPK)在慢性炎症中发挥重要作用,几条酶联通路已被阐明,p38 MAPK通路就是其中一种。它在细胞应激状态下被激活,调控炎症因子表达。
在COPD患者肺泡巨噬细胞中,p38 MAPK处于激活状态。SD-282是p38-α 亚型的一种强效小分子抑制剂,在体外能有效抑制人肺巨噬细胞释放TNF-α,并能有效抑制吸烟COPD小鼠模型的炎症。几种已进入临床试验的p38 MAPK 抑制剂暴露出副反应和毒性等问题,可能需吸入给药。
所有p38 MAPK 抑制剂都针对p38-α 和(或)p38-β亚型。p38-γ 和 p38-δ 亚型的功能尚未明确。p38-δ亚型在人肺泡巨噬细胞中表达水平很高,但作用不明。
NF-κB抑制剂
核因子(NF)-κB调节CXCL8及其他趋化因子、TNF-α及其他炎症细胞因子、MMP9的表达。COPD患者巨噬细胞和上皮细胞中NF-κB处于被激活状态,在多条可能抑制NF-κB的途径中,NF-κB激酶(IKK)2的小分子抑制物可能最有前景。
有一种IKK2抑制剂在一些脂多糖诱导的COPD动物模型中有效,但在其他(如中性粒细胞弹性蛋白酶灌注诱导者)模型中却无效,表明其机制可能很复杂。多种IKK2抑制剂现正处于开发阶段,尚未用于COPD患者。对于长期抑制NF-κB是否导致免疫功能受损,研究者仍存疑虑。
PI3K抑制剂
磷脂酰肌醇3激酶(PI3K)通过脂类第二信使调节细胞活动,包括固有和适应性免疫反应。
PI3K-γ亚型参与中性粒细胞的募集和活化,敲除PI3K-γ基因导致中性粒细胞迁移和活化能力下降、T淋巴细胞和巨噬细胞功能受损,因此,PI3K-γ抑制剂可能有抗炎症作用。
PI3K-δ也与炎症基因表达有关,目前正在开发几种PI3K-δ或混合性PI3K-γ/δ抑制剂。
PPAR激活剂
过氧化物酶增殖物激活受体(PPAR)是一类配体激活的核激素受体,属于类固醇受体超家族,已确认的三种亚型PPAR-α、PPAR-γ和 PPAR-δ表达很广泛。
研究表明PPAR-α 和 PPAR-δ激活可能有抗炎和免疫调节作用。PPAR-γ激动剂如曲格列酮(troglitazone)和罗格列酮(rosiglitazone)能抑制单核细胞释放细胞因子,并诱导T细胞凋亡,提示它们可能有抗COPD炎症作用。
COPD患者骨骼肌中PPAR-α表达下调,且与肌无力有关,提示PPAR-α激动剂如氯苯丁酯(clofibrate)可能有助于治疗重症患者的肌无力。
炎症介质拮抗剂
脂质拮抗剂
COPD患者痰液和支气管肺泡灌洗液中白三烯B4 (LTB4)含量增加,LTB4对中性粒细胞和淋巴细胞有趋化作用。
目前已有几种针对LTB4主要受体——LTB4受体1(BLT1)的拮抗剂,但将其应用于COPD患者的临床研究只得到阴性结果。理论上讲,5-脂氧合酶抑制剂能通过阻断内源性LTB 4产生而对COPD患者有益,但开发安全高效的5-脂氧合酶抑制剂却很困难。
细胞因子抑制剂
肿瘤坏死因子(TNF)-α是COPD的一种关键介质。然而,使用对类风湿关节炎和哮喘患者有效剂量的英夫利西(抗TNF-α单抗)却并未给COPD患者带来临床获益。
值得特别关注的是,研究提示接受抗TNF治疗的COPD患者发生呼吸道癌症和严重肺部感染的风险升高。
目前研究的其他细胞因子靶点还包括白介素(IL)-1β、IL-6和IL-17。IL-6受体抗体tocilizumab是一种强效IL-6抑制剂,能有效治疗类风湿关节炎,但尚未在COPD患者中进行研究。
趋化因子拮抗剂
研究者对于小分子的趋化因子受体拮抗剂怀有浓厚兴趣。
一种CXC配体(CXCL)8(即IL-8)的阻断性抗体能轻微改善COPD患者的呼吸困难症状,其他CXC趋化因子如CXCL1(GRO-α)和CXCL5(表皮衍生中性粒细胞诱导因子-78)在COPD患者中也增加,且与CXCL8作用相似。
CXCL8、CXCL1和CXCL5通过共同受体——CXC受体(CXCR) 2对中性粒细胞和单核细胞产生趋化作用。
最近研究表明,一种CXCR1/2 拮抗剂(ADZ8309)能抑制健康志愿者吸入内毒素后出现的肺内中性粒细胞炎症。其口服给药途径对于COPD患者可能是一种特殊的优势。
CXCR3的配体CXCL9、CXCL10和CXCL11在COPD患者体内浓度均升高,且表达CXCR3的T细胞数量也增加,因此CXCR3可能成为另一个药物靶点。CXCR3拮抗剂目前尚未在COPD患者中进行研究。
COPD患者体内CCL5[即调节正常T细胞表达和分泌因子(RANTES)]水平也升高。CCR5拮抗剂如马拉韦罗(maraviroc)目前已被用于治疗艾滋病,也有望在COPD患者中进行检测。
TGF-β抑制剂
研究证实,小气道纤维化是COPD患者一秒钟用力呼气容积(FEV1)和活动能力进行性下降的主要原因之一,转化生长因子(TGF)-β可能在其中起关键作用。
在氧化应激状态下或患者吸烟时,TGF-β可被激活。COPD患者小气道内TGF-β相关基因表达上调。TGF-β受体酪氨酸激酶(激动素受体样激酶5)的小分子抑制剂如SD-280已经问世。并在一种哮喘模型中被证实能抑制气道纤维化。
然而,TGF-β对维持调节型T淋巴细胞水平有重要作用,长期TGF-β抑制可能产生副作用。鉴于TGF-β很多功能是通过结缔组织生长因子介导的,抑制该因子或其受体可能是一条同样有效而更安全的途径。
肺再生
维A酸
维A酸在肺脏发育过程中增加肺泡分隔,在成年大鼠和小鼠中能逆转弹性蛋白酶处理导致的组织学和生理学变化,但在其他物种中尚未证实这种作用。人类肺泡形成在大约6岁时就已停止,因此研究者对于肺气肿是否可逆仍存争议。
一项临床研究使用全反式维A酸和9-顺式维A酸治疗肺气肿患者6个月之后,临床指标、患者健康状态或CT扫描密度未显示出任何改善。
干细胞
COPD患者气道阻塞的主要原因之一在于肺实质蛋白水解破坏导致弹性回缩力丢失,仅靠药物治疗很难逆转这一现象。
研究证实人胚胎干细胞被转化成肺泡Ⅱ型上皮细胞,后者具有修复损伤肺泡的能力。成人骨髓来源的干细胞可能也适合肺部定植,特别在经维A酸或粒细胞-巨噬细胞集落刺激因子增强处理之后更宜定植。
然而,人们对使用干细胞修复肺损伤还有一些顾虑。首先,如何把这些细胞移植到肺泡或许在技术上是个问题,并且可能有出现癌症或畸胎瘤的风险。肺是一种复杂的器官,它可能需要内皮和肺泡细胞一同生长来修复损伤。
干细胞治疗流程示意图
逆转皮质类固醇抵抗
对于延缓COPD进展,即使大剂量皮质类固醇也收效甚微,这可能是由氧化和硝化应激导致组蛋白去乙酰化酶2(HDAC2)减少,使皮质类固醇受体乙酰化程度增加,阻止受体抑制NF-κB驱动的炎症。因此,通过提高HDAC2表达和活性来逆转皮质类固醇抵抗可能是一种新的治疗策略。
茶碱
口服低剂量茶碱可增加COPD患者肺泡巨噬细胞中HDAC2表达,继而可能恢复对皮质类固醇的反应性。
茶碱作用的分子机制似乎并不依赖于PDE抑制,这可能有助于探索新型治疗手段,以此重建对皮质类固醇的反应性,并避免茶碱本身的副作用和药物间相互作用。
抗氧化剂
COPD患者体内氧化压力增加,在病情急性加重时更明显。反应性氧衍生物参与了该病理过程。氧化应激抑制HDAC2活性和表达,从而降低了患者对皮质类固醇的反应性,而抗氧化剂有可能逆转皮质类固醇抵抗。
遗憾的是,目前基于谷胱甘肽的抗氧化剂相对较弱,且会被氧化应激灭活,因此需要新的更强更稳定的抗氧化剂,比如超氧化物歧化酶类似物和烟酰胺腺嘌呤二核苷酸磷酸氢氧化酶抑制剂。
大环内酯类
大环内酯类药物似乎是通过抑制NF-κB和其他转录因子来抑制炎症,这种抗炎症作用可能与其抗生素作用无关。最近发现一种非抗生素类大环内酯药物(EM-703)可增加HDAC2活性,逆转氧化应激所致的皮质类固醇抵抗。目前多种非抗生素类大环内酯抗炎药物正在研发中。
相关热词搜索:
上一篇:病毒和细菌感染区别
下一篇:手足口病预防控制指南
频道总排行
频道本月排行
热门购物
评论排行
- 2011年临床执业医师考试实践技能真...(13)
- 腋臭手术视频(12)
- 2008年考研英语真题及参考答案(5)
- 节食挑食最伤女人的免疫系统(5)
- 核辐射的定义和单位(5)
- CKD患者Tm与IMT相关(5)
- 齐鲁医院普外科开展“喉返神经监护...(5)
- windows7激活工具WIN7 Activation v1.7(5)
- 正常微循环(5)
- 美大学性教育课来真的 男女上阵亲...(4)