第三章 血液
2011-06-08 18:14:09 来源: 作者: 评论:0 点击:
一、血小板的止血功能
(Hemostatic function of platelets)
正常情况下,血小板在血液中呈双凸圆盘状,不与血管内皮表面接触。当血管受到损伤时,血管内皮下胶原纤维被暴露,血小板会迅速粘附在胶原纤维上,并发生形态改变,由原来的盘状变为球形,表面伸出许多伪足,随后血小板开始聚集、释放等反应,使更多的血小板参与此反应,形成松软的血小板栓子,实现初期止血。血管损伤暴露的组织因子和血小板栓子等均可启动凝血过程,形成纤维蛋白网,共同完成第二期止血。血小板在凝血过程中也有非常重要的作用:① 激活的血小板为凝血过程提供了活性表面,如FⅨa-FⅧa复合物和FⅩa-FⅤa复合物等在血小板质膜表面,一方面使其活性大大增强,避免被其它酶破坏,另一方面,也有助于凝血过程局部化,使凝血过程仅发生于血管损伤处被活化的血小板表面。② 血小板质膜表面结合有许多凝血因子,如纤维蛋白原、FⅤ、FⅪ等,这些因子的相继激活可加速凝血过程。③ 血小板激活后,血小板胞浆颗粒内容物的释放,如α-颗粒内的纤维蛋白原等,可增加纤维蛋白的形成,加固血凝块。④ 血凝块中的血小板伪足伸入纤维蛋白网,在血小板的伪足内存在成束的收缩蛋白,这些收缩蛋白是血小板骨架的一部分,它们和血小板的跨膜受体的胞内段结合(如GPⅡb-Ⅲa等),收缩蛋白的收缩可以通过跨膜受体的传递作用,引起整个血块的回缩,挤出血块中的血清而使血凝块成为坚实的止血栓,牢固地封住血管破口,不仅巩固第二期止血,而且进入永久性止血。在电镜下可以看到,血小板位于纤维蛋白网的结点处,纤维蛋白丝附着于血小板的伪足而形成一个立体的网络结构。血小板的伪足收缩,牵动纤维蛋白丝而使整个血块回缩。当血小板计数低于50×109/L时,血块回缩缓慢且不完全。血块回缩还与纤维蛋白原含量和红细胞计数有关,纤维蛋白原含量减少或红细胞相对增多,都会使血块回缩不完全。在临床上,阿司匹林、噻氯匹定等作为抗血小板药物,应用于血栓栓塞性疾病(如心肌梗塞、脑栓塞等)的治疗。
二、血液凝固与抗凝系统
(Blood coagulation and anticlotting systems)
(一)血液凝固
血液凝固(blood coagulation)简称血凝,指血液由流动的液体状态变成不能流动的凝胶状态的过程,其实质就是呈液体状态(溶于水)的纤维蛋白原转变为凝胶状态(不溶于水)的纤维蛋白的生化过程。目前认为血液凝固是由一系列凝血因子参与的、复杂的蛋白质酶解过程。
1.凝血因子
表3-3 凝血因子的编号、同义名和合成部位
编号 同义名 合成部位
因子Ⅰ因子Ⅱ因子Ⅲ因子Ⅳ因子Ⅴ因子Ⅶ因子Ⅷ因子Ⅸ因子Ⅹ因子Ⅺ因子Ⅻ因子ⅩⅢ未编号未编号 纤维蛋白原(fibrinogen)凝血酶原(prothrombin)组织因子(tissue factor,TF)钙离子(Ca2+)前加速素(proaccelerin)前转变素(proconvertin)抗血友病因子(antihemophilic factor,AHF)血浆凝血激酶(plasma thromboplastic component,PTC)Stuart-Prower因子(Stuart-Prower factor)血浆凝血激酶前质(plasma thromboplastin antecedent,PTA)接触因子(contact factor)或Hageman factor纤维蛋白稳定因子(fibrin-stabilizing factor)高分子量激肽原(High-molecular weight kininogen, HMW-K)前激肽释放酶(prekallikrein,Pre-K)或Fletcher factor 肝细胞肝细胞(需Vit.K)内皮细胞和许多细胞-内皮细胞和血小板肝细胞(需Vit.K)肝细胞肝细胞(需Vit.K)肝细胞(需Vit.K)肝细胞肝细胞肝细胞和血小板肝细胞肝细胞
血浆与组织中直接参与血液凝固的物质,统称为凝血因子(blood clotting factor)。凝血因子有二十多种,其中由国际凝血因子命名委员会以罗马数字编号的有12种,即凝血因子Ⅰ-ⅩⅢ(简称FⅠ-FⅩⅢ,其中FⅥ就是血清中的FⅤa,故取消);未编号的有前激肽释放酶、高分子量激肽原以及血小板磷脂等(表3-3)。在凝血因子中,除钙离子和磷脂外,其余已知的凝血因子都是蛋白质,其中大部分是以无活性的酶原形式存在的蛋白酶,被激活的凝血因子在右下角标"a"(activated)表示,如FⅫ被激活后成为FⅫa。在凝血过程中,起酶促作用的凝血因子有FⅡ、FⅦ、FⅨ、FⅩ、FⅪ、FⅫ、FⅩⅢ和前激肽释放酶等,它们都是丝氨酸蛋白酶(内切酶),每一种酶只能对特定的肽链进行有限的水解;起辅因子作用的凝血因子有FⅢ、FⅣ、FⅤ、FⅧ和高分子量激肽原。另外 ,FⅡ、FⅦ、FⅨ、FⅩ的生成需要维生素K参与,故又称依赖维生素K的凝血因子,如果维生素K缺乏,则使这些凝血因子合成障碍。当凝血因子缺乏或不足时,可引起出血性疾病,如血友病A(hemophilia A)为FⅧ缺乏或缺陷,血友病B为FⅨ缺乏,血友病C为FⅪ缺乏等。
2.凝血过程
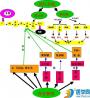
人们对凝血过程的认识以"瀑布学说"为基础而形成,认为凝血过程是一系列凝血因子相继酶解激活的级联反应过程,一般被分为外源性凝血途径(extrinsic pathway of blood coagulation) 和内源性凝血途径(intrinsic pathway of blood coagulation),两条凝血途径的主要区别在于启动方式和参加的凝血因子不完全相同,同时两条途径中的凝血因子也能相互激活,两条途径的共同通路为激活FⅩ,由此生成凝血酶,而最终形成纤维蛋白凝块。 (1)外源性凝血途径 外源性凝血途径是指始动凝血的FⅢ是来自组织,而不是来自血液。FⅢ是存在于多种细胞的细胞膜上的一种跨膜糖蛋白。在生理情况下,FⅢ不出现于血液中,血管内皮细胞和血细胞表面也无FⅢ表达。但当血管损伤或血管内皮细胞和单核细胞受到一些因素(如细菌内毒素、补体C5a、免疫复合物、肿瘤坏死因子等)刺激时,FⅢ将得以与血液接触,并作为FⅦ和(或)FⅦa的受体与其相结合形成1:1复合物。FⅦa- FⅢ复合物形成后,在Ca2+的存在下,发挥两方面作用:第一,激活FⅩ使其成为FⅩa。在FX激活过程中,FⅦa作为蛋白酶而发挥对FⅩ分子的酶解作用,FⅢ是辅因子,它能使FⅦa的催化效力提高1 000倍。生成的FⅩa又能反过来激活FⅦ而成为FⅦa,因此能生成更多的FⅩa,形成外源性凝血途径的正反馈效应。第二,激活FⅨ而成为FⅨa。FⅨa生成后,除反过来激活FⅦ外,还能与FⅧa等结合形成复合物,激活FⅩ而成为FⅩa,从而使外源性凝血途径与内源性凝血途径联系起来共同完成凝血过程。目前普遍认为外源性凝血途径对血管破裂后整个凝血过程的启动有非常重要的作用,FⅢ被认为是生理性凝血过程的"启动物"(trigger或 initiator),另外,FⅢ靠其与细胞膜的紧密结合还可能起着"锚"(anchor)定作用,使生理性凝血过程局限于受损伤血管的部位。
(2)内源性凝血途径 内源性凝血途径是指参与凝血的因子全部来自血液。当血液与带负电荷的异物表面(如胶原和玻璃等)接触时,首先是FⅫ结合到异物表面而自身激活为FⅫa。FⅫa有三种作用:①裂解高分子量激肽原分子中的赖氨酸(380)-精氨酸(381)和精氨酸(389)-丝氨酸(390)肽键,裂解后的高分子量激肽原很快与异物表面结合,把前激肽释放酶和FⅪ带到异物表面;②裂解前激肽释放酶,使其转变为激肽释放酶,该酶一方面裂解FⅫ,生成更多的FⅫa,形成FⅫ激活的正反馈环路,另一方面还能裂解高分子量激肽原;③裂解FⅪ,使其转变为FⅪa。在上述激活过程中,高分子量激肽原起着辅因子的作用,能大大加速FⅫ、前激肽释放酶以及FⅪ的激活。在Ca2+存在的条件下,生成的FⅪa再激活FⅨ而成为FⅨa。FⅨ的激活反应主要在液相中进行,激活反应的速度较慢,为凝血过程中的一个重要的调速步骤。FⅨa生成后再与FⅧa、Ca2+在血小板磷脂膜上结合为复合物,激活FⅩ而成为FⅩa;在此过程中,FⅧa是一个十分重要的辅因子,它可以使反应速度提高20万倍。FⅧ存在于血浆中,通常与vWF以非共价键结合成复合物,因此,FⅧ必须先从这个复合物释出后才能裂解生成FⅧa。
FⅩa生成以后的凝血过程是外源性和内源性凝血途径所共同拥有的通路。在Ca2+存在的情况下,FⅩa与FⅤa在磷脂膜表面结合成1:1复合物,称为凝血酶原激活物(prothrombin activator),其中,FⅩa是直接发挥蛋白水解作用的蛋白酶,FⅤa作为辅因子能使FⅩa对凝血酶原激活反应的最大速率提高近10 000倍,磷脂的存在又可使凝血酶原的Km值降低150倍。凝血酶原激活物酶解凝血酶原为凝血酶,凝血酶(thrombin)是一种多功能的凝血因子,在凝血过程中发挥如下作用:①主要作用是使纤维蛋白原分解为纤维蛋白单体,并激活FⅩⅢ以促进纤维蛋白的交联。②可激活FⅤ、FⅦ、FⅧ、FⅪ等和使血小板活化而提供凝血因子相互作用的有效膜表面,产生更多的凝血酶,使凝血过程不断加速;③可直接或间接激活蛋白质C系统,灭活FⅤa和FⅧa,从而制约凝血过程的继续,这也是使凝血过程局限于损伤部位的机制之一。最后,纤维蛋白单体生成后即相互聚合为纤维蛋白,然后在FⅩⅢa和Ca2+的作用下,这些纤维蛋白经过交联后形成不溶于水的纤维蛋白凝块,完成凝血过程。(图3-12)。
(二)抗凝系统
在生理情况下,机体血管损伤产生的凝血过程仅限于受损的局部,不会扩展到全身并阻碍血液循环。这意味着体内还存在着与凝血系统相对抗的抗凝系统(anticlotting systems)。目前知道体内的抗凝系统包括细胞抗凝系统和体液抗凝系统。细胞抗凝系统包括血管内皮细胞和网状内皮系统细胞。血管内皮细胞表面光滑,可以防止内源性凝血系统的激活,内皮细胞生成的PGI2、NO、硫酸乙酰肝素、抗凝血酶Ⅲ、血栓调节蛋白等都具有抗凝作用。网状内皮系统细胞通过清除进入血液循环的促凝物质以实现抗凝,实验证明,当给动物注射凝血酶时,动物不发生弥漫性血管内凝血(disseminated intravascular coagulation, DIC),若事先给以墨汁封闭网状内皮系统,则发生DIC。在抗凝功能中发挥更重要作用的是体液抗凝系统,下面介绍体液抗凝系统中的几种主要抗凝物质:
1.丝氨酸蛋白酶抑制物
丝氨酸蛋白酶抑制物(serine protease inhibitor)是指与α1-抗胰蛋白酶同源的超家族,在结构上都是单链蛋白,在功能上它们均依靠诱捕机制(trapping mechanism)灭活丝氨酸蛋白酶。这类物质主要有抗凝血酶Ⅲ、肝素辅因子Ⅱ、C1抑制物、α1-抗胰蛋白酶、蛋白酶连素1等。其中,最重要的是由肝细胞、血管内皮细胞和巨核细胞等分泌的抗凝血酶Ⅲ(antithrombin Ⅲ,AT-Ⅲ),它含有432个氨基酸残基,通过本身分子中的精氨酸(393)的羧基与凝血酶、FⅨa、FⅩa和FⅫa活性中心的丝氨酸的羟基结合,形成1:1的非可逆性复合物,从而使这些凝血因子灭活,实现抗凝作用。在正常情况下,抗凝血酶Ⅲ的直接抗凝作用非常慢而弱,不能有效地抑制凝血,但它与肝素结合后,其抗凝作用可增加约2 000倍。抗凝血酶Ⅲ缺乏是发生静脉血栓与肺栓塞的常见原因之一,但与动脉血栓形成关系不大。
2.组织因子途径抑制物
组织因子途径抑制物(tissue factor pathway inhibitor, TFPI)主要由小血管内皮细胞合成,血浆中浓度约(1.5~3.4)nmol/L,为体内主要的生理性抗凝物质。它是一种由276个氨基酸残基组成的相对稳定的糖蛋白,其分子中含有三个串联的Kunitz型抑制功能域,即K1、K2和K3。其中,K1能与FⅦa-FⅢ结合,K2能与FⅩa结合,K3的作用未明。TFPI的抗凝作用分两步进行:第一步是K2与FⅩa结合,直接抑制FⅩa的催化活性,并使TFPI变构;第二步是在Ca2+存在的条件下,变构的TFPI再与FⅦa-FⅢ结合,形成FⅩa-TFPI-FⅦa-FⅢ四合体,从而灭活FⅦa-FⅢ复合物,发挥负反馈抑制外源性凝血途径的作用。
3.蛋白质C系统
蛋白质C系统(protein C system)主要包括蛋白质C(protein C,PC)、凝血酶调制素(thrombomodulin,TM)、蛋白质S和蛋白质C抑制物。蛋白质C是由肝脏合成的双链糖蛋白,分子量为62 000,本身属于维生素K依赖因子。它以酶原形式存在于血浆中,当凝血酶与血管内皮细胞上的凝血酶调制素结合后,凝血酶能从蛋白质C分子上裂解一个小肽,从而成为激活的蛋白质C。激活的蛋白质C是一种丝氨酸蛋白酶,主要有以下作用:① 蛋白质C在磷脂和Ca2+存在的情况下可水解灭活凝血辅因子FⅤa和FⅧa;② 阻碍FⅩa与血小板磷脂膜上FⅤa的结合,从而削弱FⅩa对凝血酶原的激活作用;③ 刺激纤溶酶原激活物的释放,增强纤溶酶活性,从而促进纤维蛋白溶解。血浆中的蛋白质S可使激活的蛋白质C的作用大大增强。
4.肝素
肝素(heparin)是一种酸性粘多糖,主要由肥大细胞和嗜碱性粒细胞产生,肥大细胞广泛分布于毛细血管的周围组织中。肝素是一种有效的抗凝物质,生理情况下血浆中含量甚微,临床上把它作为一种抗凝剂广泛应用于防治血栓栓塞性疾病。肝素的抗凝机制主要有三个方面:① 增强血浆中一些抗凝蛋白质的抗凝活性。如肝素与抗凝血酶Ⅲ结合,可显著增加抗凝血酶Ⅲ的抗凝作用;肝素与肝素辅助因子Ⅱ结合后,肝素辅助因子Ⅱ灭活凝血酶的速度可加快1000倍;肝素还可增强蛋白质C抑制物对凝血酶和FⅩa的灭活作用。② 可刺激血管内皮细胞大量释放TFPI,这也是肝素的抗凝作用在体内远强于体外的原因。③ 抑制单核细胞和血管内皮细胞表达FⅢ,这对预防炎症时微血栓形成具有重要意义。肝素除有抗凝作用外,还能刺激血管内皮细胞释放纤溶酶原激活物,增强纤维蛋白溶解;抑制血管内皮细胞、血管平滑肌细胞和肾间质细胞的生长;增加血管通透性等。
三、纤维蛋白溶解与抗纤溶
(Fibrinolysis and antifibrinolysis)
(一)纤维蛋白溶解
纤维蛋白溶解(fibrinolysis)简称纤溶,指纤维蛋白沉积物和纤维蛋白凝块重新液化的过程。纤溶系统的作用是清除在生理性止血过程中产生的纤维蛋白凝块,防止永久血栓形成,保证血流通畅;此外,纤溶系统还具有参与组织修复、血管再生等多种作用。纤溶系统主要包括纤维蛋白溶酶原(plasminogen,简称纤溶酶原)、纤溶酶(plasmin,又称血浆素)、纤溶酶原激活物(plasminogen activator)与纤溶抑制物。纤溶的基本过程分为两个阶段,即纤溶酶原的激活和纤维蛋白(或纤维蛋白原)的降解。
1.纤溶酶原的激活
纤溶酶原主要由肝脏、嗜酸性粒细胞和肾脏合成,是一种含791个氨基酸残基的单链糖蛋白,分子量为92 000,正常人血浆中的浓度约为(100~200)mg/L。纤溶酶原在各种纤溶酶原激活物的作用下,脱下一段肽链,成为纤溶酶。纤溶酶原的激活途径有两条:其一是由内源性凝血系统的有关凝血因子,如FⅫa、激肽释放酶等,使纤溶酶原转变为纤溶酶,这一途径也称内源性激活途径;其二是由来自血管内皮细胞、单核细胞、巨核细胞等合成的组织型纤溶酶原激活物(tissue plasminogen activator,tPA)和由肾脏合成的尿激酶(urokinase或urokinase plasminogen activator,uPA),使纤溶酶原转变为纤溶酶,也称外源性激活途径。纤溶酶属于丝氨酸蛋白酶,主要功能是水解纤维蛋白和纤维蛋白原,另外,还能水解凝血酶、FⅤa、FⅧa和FⅫa等。目前,尿激酶、组织型纤溶酶原激活物等已被作为溶血栓药物,用于治疗血栓栓塞性疾病,如心肌梗塞、脑血栓等。
2.纤维蛋白与纤维蛋白原的降解
纤溶酶可使纤维蛋白或纤维蛋白原肽链分子中的赖氨酸-精氨酸肽键裂解,而变成许多可溶性的小肽,称为纤维蛋白降解产物(fibrin degradation products,FDP)。纤维蛋白降解产物通常不再发生凝固,相反,其中一部分有抗凝血作用。
(二)抗纤溶
人体内存在许多物质可抑制纤溶系统的活性,包括纤溶酶原激活物抑制物(plasminogen activator inhibitor,PAI)和纤溶酶抑制物(plasmin inhibitor,PI) 两类。前者包括PAI-1、PAI-2、PAI-3等,主要灭活组织型纤溶酶原激活物和尿激酶。后者包括α2-抗纤溶酶(α2-antiplasmin,α2AP)、α2-巨球蛋白(α2-macroglobulin)、补体C1抑制物(complement C1 inhibitor)、富组氨酸糖蛋白(histidine-rich glycoprotein,HRGP)、凝血酶活化纤溶抑制物(thrombin-activatable fibrinolysis inhibitor,TAFI)等,其中α2-抗纤溶酶、α2-巨球蛋白和补体C1抑制物主要抑制纤溶酶的活性,富组氨酸糖蛋白、凝血酶活化纤溶抑制物主要减少纤溶酶的生成。
上述纤溶抑制物多数是丝氨酸蛋白酶的抑制物,特异性不高,如α2-巨球蛋白除可抑制纤溶酶外,还能抑制凝血酶、激肽释放酶等。因此,这些抑制物既可抑制纤溶又可抑制凝血,这对于凝血与纤溶局限于创伤局部有重要意义。
相关热词搜索:血液
上一篇:第二章 细胞的基本功能
下一篇:第四章 血液循环
精彩图文
频道总排行
频道本月排行
- 158第十章 感觉器官的功能
- 146第五章 呼吸
- 75第八章 体温
- 42第六章 消化和吸收
- 37第一章 绪论
- 25第十三章 生殖
- 4第三章 血液
- 3第七章 能量代谢
- 3第九章 尿液的生成与排泄
- 2第十二章 内分泌系统
热门购物
评论排行
- 2011年临床执业医师考试实践技能真...(13)
- 腋臭手术视频(12)
- 2008年考研英语真题及参考答案(5)
- 节食挑食最伤女人的免疫系统(5)
- 核辐射的定义和单位(5)
- CKD患者Tm与IMT相关(5)
- 齐鲁医院普外科开展“喉返神经监护...(5)
- windows7激活工具WIN7 Activation v1.7(5)
- 正常微循环(5)
- 美大学性教育课来真的 男女上阵亲...(4)