第三章 血液
2011-06-08 18:14:09 来源: 作者: 评论:0 点击:
第二节 血细胞
(Blood cell)
关于血细胞的来源,曾存在一元论和多元论的长期争论。1961年,Till和McCulloch用致死量放射线照射受体小鼠,破坏其自身的骨髓细胞,然后给其输注同种骨髓细胞(即骨髓移植),在输注8天~10天后,发现受体小鼠的脾脏表面出现了一些肉眼可见的集落,称为脾集落形成单位(colony forming unit-spleen,CFU-S),其中有的集落由单一的红系、粒系或巨核系细胞组成,另一些集落由上述两种或两种以上血细胞混合组成,如果将脾集落内的细胞再移植给其它受致死量放射性照射的小鼠,小鼠的脾脏上又能形成脾集落,从而使小鼠存活。1963年,Becker用辐射诱发染色体畸变作为标志,发现同一脾集落内的细胞具有相同的标志,证明了每个脾集落是由一个细胞增殖分化而来。1977年,Abramson将带有独特放射损伤染色体标志的骨髓细胞输入有造血干细胞缺陷的W/WV小鼠(即此模型小鼠本身没有造血干细胞),结果出现了三种不同情况:有些小鼠的骨髓细胞、脾脏、淋巴结、胸腺细胞和脾集落细胞都具有同样的染色标志;另一些小鼠,只有骨髓细胞和CFU-S中的细胞具有相同的染色体标志;还有一些小鼠仅在胸腺和植物血凝素刺激的脾细胞中出现畸变染色体。上述实验结果证明,1909年Maximov提出的造血一元论基本上是正确的,即血细胞来源于一种造血干细胞,其能重建造血系统并维持个体整个生命过程中成熟血细胞的相对稳定。这些实验结果还表明,小鼠骨髓中的造血干细胞是一个不均一的细胞群体,具有自我更新(self-renewal)和多能分化(pluripotent differentiation)两个最基本的特征。
通常认为,造血干细胞只能生成各系血细胞。但是,近年来的一系列实验表明,造血干细胞具有超过人们想象的可塑性,除可以分化为各系血细胞外,还可以分化为多种非造血组织的细胞,如神经细胞、骨骼肌细胞、心肌细胞、肝脏细胞、血管内皮细胞以及多种组织的上皮细胞等。这些实验的前提条件都是将造血干细胞置于与以往不同的环境中,这样就使造血干细胞的分化不仅受到细胞内在的调控,而且受到周围细胞的分化信号调节,进行定向分化。
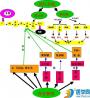
在个体发育过程中,造血中心先后发生多次转移,因而相应地将造血过程分为三个期,即卵黄囊造血期、胎肝造血期和骨髓造血期。在胚胎发育的早期,造血最初发生在卵黄囊的血岛上;从胚胎第2个月开始,肝、脾造血;胚胎发育到第4个月以后,肝、脾的造血活动逐渐减少,由骨髓造血取而代之;到婴儿出生时,几乎完全依靠骨髓造血,但在造血需要增加时,肝、脾可再参与造血以补充骨髓功能的不足。因此,此时的骨髓外造血具有代偿作用。儿童到4岁以后,骨髓腔的增长速度已超过造血组织增加的速度,脂肪细胞逐步填充多余的骨髓腔。到18岁左右,虽然只有脊椎骨、髂骨、肋骨、胸骨、颅骨和长骨近端骨骺处才有造血骨髓,但造血组织的总量已很充裕(图3-3)。
图3-3 个体发育过程中造血中心的转移
造血中心发生多次转移的机理尚不完全清楚。研究资料证明,某一器官造血活性主要由其所处的微环境决定,有造血活性器官的基质比无造血活性器官的基质能更好地支持造血细胞的增殖,另外,表达于造血干细胞表面的一系列细胞
粘附分子(cell adhesion molecule,CAM)在调节造血干细胞的迁移和定居方面也发挥重要作用,如整合素(integrin)、选择素(selectin)等。
一、造血过程
(Genesis of blood cells)
造血过程(Genesis of blood cells)也就是各类造血细胞的发育、成熟的过程,它是一个连续而又分阶段的过程。首先是造血干细胞(hematopoietic stem cells)阶段,造血干细胞经过不对称性有丝分裂形成两个子代细胞,其中一个仍维持造血干细胞的全部特征,另一个子细胞可能由于基因表达模式发生改变而使细胞特征出现变化,分化形成造血祖细胞;第二个阶段是造血祖细胞(hematopoietic progenitor cell)阶段,早期的造血祖细胞仍具有多向分化能力,称为多能祖细胞(multipotential progenitor cell),晚期的造血祖细胞只能向特定系分化,称为定向祖细胞(committed progenitor cell),可以区分为红系集落形成单位 (colony forming unit-erythrocytes,CFU-E)、粒-单核系集落形成单位 (colony forming unit-granulocytes and monocytes,CFU-GM)、巨核系集落形成单位 (colony forming unit-megakaryocytes,CFU-MK)和淋巴系集落形成单位 (colony forming unit-lymphocytes,CFU-L);第三个阶段是形态可辨认的前体细胞(precursors)阶段,此时的造血细胞已经发育成为形态上可以辨认的各系幼稚细胞,这些细胞进一步发育成熟为具有特殊功能的各类终末血细胞,然后有规律地释放进入血液循环。应该指出,每一阶段的细胞都是不均一的(图3-4)。
在造血组织中的造血干细胞和造血祖细胞,由于在形态学上无法与其它单个核细胞相区别,目前主要采用集落形成测定法和细胞表面抗原测定法进行鉴别。集落形成测定法是采用体外培养中形成的各种集落形成单位(colony forming unit,CFU)来进行研究(图3-4);细胞表面抗原测定法是利用单克隆抗体和流式细胞仪的荧光激活细胞分类术(fluorescence activated cell sorting,FACS),根据造血干细胞在分化过程的不同阶段出现或消失的细胞表面标记-分化群(cluster of differentiation,CD),分离和鉴定不同阶段的造血干细胞和造血祖细胞(图3-5)。其中CD34抗原是分选造血干细胞和造血祖细胞的主要标志,细胞表面的CD34抗原在造血干细胞为强阳性,在多能祖细胞为阳性,它的表达一直持续到定向祖细胞。多能祖细胞出现了CD33、CD38、HLA-DR等分化抗原的阳性,在定向祖细胞时出现了"系特异性抗原"(lineage specific antigen ,Lin抗原),包括粒系的CD11、CD13、CD15、CD16等,单核系的CD14,B淋巴系的CD19、CD20、CD21、CD22,T/NK系的CD2、CD7、CD11、CD25、CD56,红系的CD36、CD47、CD59、CD71以及巨核系的CD31、CD41、CD42、CD61、CD63、CD107等等。例如在外周血造血干细胞移植时,以CD34+CD38-作为指标,用细胞表面抗原测定法可以快速、准确地检测用于移植的造血干细胞的数量,以保证移植的成功。细胞表面抗原测定法还被用于区分血细胞分化和发育过程中的不同阶段,如B淋巴细胞的分化和发育过程经历了淋巴系多能祖细胞→前B细胞→未成熟B细胞→成熟B细胞→浆细胞等阶段,其每一阶段都有特异性细胞表面抗原表达(图3-5)。造血干细胞具有的自我复制与多向分化的能力,使其在某些疾病的治疗中发挥越来越重要的作用。造血干细胞移植是治疗许多恶性血液病(如白血病、再生障碍性贫血等)的一种有效的措施,也是大剂量细胞毒性制剂和放射线导致严重造血损伤救治中的一种不可缺少的重要措施。此外,在基因治疗中,将目的基因导入造血干细胞,然后输入患者体内,可以治疗地中海贫血、重症联合免疫缺陷病等遗传性疾病。造血干细胞主要存在于骨髓、外周血(含脐带血)以及胎儿肝脏中,临床上采集造血干细胞的途径多为骨髓、外周血和脐带血。
造血过程主要是在造血组织的造血微环境中进行的。造血微环境(hematopoietic microenvironment)包括造血器官中的基质细胞、基质细胞分泌的细胞外基质、各种造血调节因子以及进入造血器官的神经和血管。基质细胞包括成纤维细胞、网状外膜细胞、窦内皮细胞、组织巨噬细胞、网织细胞等,其中网状外膜细胞老化后形成巨型脂肪细胞。基质细胞有规律地分布于骨髓中,是造血功能的必要条件,一方面通过分泌体液因子影响造血细胞的生理功能,另一方面,通过细胞之间的直接接触作用于造血细胞,可影响造血细胞分化和发育。
造血干细胞和造血祖细胞在造血微环境中的增殖、分化和生存依赖多种体液因子的调节,现已发现多种因子参与造血的调控,它们可作用于血细胞生成的不同阶段。造血细胞因子按照其作用特性,可分为造血生长因子(hematopoietic growth factor,HGF)和造血抑制因子(hematopoietic inhibiting factor,HIF)。目前认为调节造血干细胞的造血生长因子主要是FL(Flt-3配基)和促血小板生成素(TPO);其它的一些体液因子,如白细胞介素l(interleukin-1,IL-1)、白细胞介素3 (IL-3)、白细胞介素6(IL-6)、干细胞因子(stem cell factor,SCF)等亦参与对造血干细胞的调节。具有抑制作用的细胞因子是转化生长因子b(transforming growth factor-b,TGF-b)和干扰素(interferon,IFN)等。一些理化(苯、χ射线和g射线)、生物(某些病毒感染)、药物(氯霉素、环磷酰胺)等因素可引起骨髓造血干细胞及造血微环境损伤,导致骨髓造血功能降低,血液中全血细胞减少,这类疾病称为再生障碍性贫血(aplastic anemia)。
二、红细胞
(Erythrocytes)
(一)红细胞的数量和形态
红细胞是血液中数量最多的血细胞。我国成年男性的红细胞数量为(4.5~5.5)×1012/L,平均5.0×l012/L;女性为(3.8~4.6)×1012/L,平均为4.2×1012/L。新生儿为6.0×1012/L以上,随后,由于体重增长速度超过红细胞生成的速度,导致血浆量相对增多,红细胞比容下降。在儿童期,红细胞数一直保持在较低水平,至青春期才逐渐接近成人水平,性别差异也逐渐明显。血红蛋白(hemoglobin,Hb)是红细胞内的主要蛋白质。我国成年男性血红蛋白浓度约为(120~160)g/L, 成年女性约为(110~150)g/L;新生儿(5天内)可达200g/L以上,6个月龄时降至最低值,一岁以后又渐渐升高,到青春期达成年人范围。红细胞数和血红蛋白浓度除有年龄、性别差异外,还受其它因素的影响,如高原居民红细胞数与血红蛋白量均高于海平面的居民。
正常成熟红细胞没有细胞核和细胞器,细胞呈双凹圆碟形,直径约7.8μm,周边最厚处为2.5μm,中央最薄处约1μm(图3-6)。
(二)红细胞的生理特征
1.红细胞膜的通透性
红细胞膜对物质有选择性通透。O2和CO2可以自由通过,负离子(如Cl-、HCO3-)较易通过红细胞膜,而正离子却很难通过。红细胞内Na+浓度远低于细胞外,而K+浓度远高于细胞外,这种细胞内外的Na+、K+浓度差主要是依靠细胞膜上Na+泵的活动来维持。低温贮存较久的血液,血浆内K+浓度升高,就是由于低温条件下代谢几乎停止,Na+泵不能活动的缘故。
2.红细胞的可塑性变形
正常成人双凹圆碟形的红细胞体积约为90μm3,表面积约为140μm2。若红细胞是等体积的球形,则其表面积仅100μm2。由于双凹圆碟形所增加的40μm2表面积,允许红细胞发生很大的变形。红细胞在全身血管中循环运行,常要挤过口径比它小的毛细血管和血窦孔隙,这时红细胞将发生变形(图3-7),在通过后又恢复原状,这种变形称为可塑性变形(plastical deformability)。红细胞的变形能力受三种因素影响:① 表面积与体积的比值愈大,变形的能力也就愈大,故双凹圆碟形红细胞的变形能力远大于异常情况下可能出现的球形红细胞;② 红细胞内的粘度愈大,变形能力愈小,当血红蛋白变性或浓度过高时,可使红细胞内粘度增加;③ 红细胞膜的弹性降低或粘度升高,也可使红细胞变形能力降低。
3.红细胞的悬浮稳定性
红细胞的悬浮稳定性(suspension stability)是指血液中的红细胞能够彼此保持一定距离而悬浮于血浆中的特性。测量方法为:将盛有抗凝血的血沉管垂直静置,红细胞由于比重大于血浆,受重力的作用而下沉,但是下沉的速度较慢。通常以红细胞在第一小时末下沉的距离表示红细胞沉降的速度,称为红细胞沉降率(erythrocyte sedimentation rate,ESR),简称血沉。正常男性为(0~15)mm/h,正常女性为(0~20)mm/h(魏氏法)。红细胞沉降率愈大,表示红细胞的悬浮稳定性愈小。
红细胞的悬浮稳定性产生的原因是由于红细胞与血浆之间的摩擦阻碍红细胞下沉,双凹圆碟形的红细胞,表面积与容积的比值较大,与血浆的接触面大,所产生的摩擦也较大,因此红细胞下沉缓慢。在某些疾病时(如活动性肺结核、风湿热等)血沉加快,主要是由于多个红细胞彼此能较快地以凹面相贴,形成红细胞叠连(rouleaux formation)。红细胞叠连之后,其表面积与容积的比值减小,与血浆接触的总面积减小,所产生的摩擦力也减小,于是血沉加快。红细胞叠连形成的快慢主要决定于血浆的变化,而不在红细胞本身。通常血浆中球蛋白、纤维蛋白原及胆固醇含量增多时,可加速红细胞叠连、沉降;血浆中白蛋白和卵磷脂含量增多时,则使红细胞叠连、沉降减慢。
4.红细胞的渗透脆性
红细胞的渗透脆性(osmotic fragility)是指红细胞在低渗盐溶液中发生膨胀、破裂和溶血的特性,用来表示红细胞对低渗盐溶液的渗透抵抗力(osmotic resistance)。红细胞的渗透脆性越大,表示红细胞的渗透抵抗力越小。
在临床或生理实验使用的各种溶液中,0.85%NaCl溶液(又称生理盐水)和5%葡萄糖溶液等,因其渗透压与血浆渗透压相等,称为等渗溶液(isosmotic solution),高于或低于血浆渗透压的溶液则相应地称为高渗溶液或低渗溶液。将正常红细胞悬浮于不同浓度的NaCl溶液中,红细胞在等渗溶液中可以保持正常大小和双凹圆碟形,在渗透压递减的一系列溶液中,红细胞逐步胀大并双侧凸起,当体积增加30%时成为球形,体积增加45%~60%时则红细胞破裂称之为溶血(hemolysis)。正常人的红细胞一般在0.42%NaCl溶液中开始出现溶血,在0.35%NaCl溶液中完全溶血。在某些溶血性疾病中,病人的红细胞开始溶血和完全溶血的NaCl溶液浓度均比正常人高,即红细胞的渗透抵抗力减小了或渗透脆性增加了。不同物质的等渗溶液不一定都能使红细胞的体积和形态保持正常;能使悬浮于其中的红细胞保持正常体积和形状的盐溶液,称为等张溶液(isotonic solution)。所谓"张力"(tonicity)实际上是指溶液中不能透过细胞膜的颗粒所造成的渗透压。例如NaCl不能自由通过细胞膜,所以0.85%NaCl既是等渗溶液,也是等张溶液;而尿素能自由通过细胞膜,故1.9%的尿素溶液虽然与血浆等渗,但将红细胞置入其中后立即发生溶血,所以不是等张溶液。一般来说,等张溶液一定是等渗溶液,而等渗溶液不一定是等张溶液。
(三)红细胞的功能
红细胞的主要功能是运输O2和CO2,其次是调节体内的酸碱平衡。O2和CO2等脂溶性气体可以自由通过红细胞膜,红细胞的双凹圆碟形使细胞内外气体交换的面积较大,由细胞中心到大部分表面的距离较短,故有利于O2和CO2的交换。在血液中由红细胞运输的O2约为溶解于血浆O2的70倍;同样由于红细胞的参与,血浆运输CO2的能力约为直接溶解于血浆中CO2的18倍。红细胞运输O2的功能是靠细胞内的血红蛋白来实现的,一旦红细胞破裂,血红蛋白逸出,即丧失运输气体的功能。红细胞运输O2,但不消耗O2,红细胞所需的能量来自葡萄糖的无氧糖酵解和磷酸戊糖旁路,能量主要用于供应细胞膜上Na+泵的活动,也用于保持红细胞膜的完整性以及细胞的双凹圆碟形。此外,红细胞内有碳酸酐酶和多种缓冲对,具有调节体内酸碱平衡的功能(见本章第一节血液的理化特性)。
(四)红细胞的生成
1.红细胞生成所需的原料
蛋白质和铁是合成血红蛋白的重要原料,蛋白质来源于肉类及豆类食物。此外,红细胞生成还需要氨基酸、维生素B6、B2、C、E和微量元素铜、锰、钴、锌等。
在红细胞生成过程中,血红蛋白的合成从原红细胞开始,持续到网织红细胞。血红蛋白由珠蛋白和血红素结合而成,其中血红素的合成需要铁。成人每天需要铁(20~25)mg,来源包括外源性铁(extrinsic iron)和内源性铁(intrinsic iron)。外源性铁指由食物供应的铁,每天吸收约1mg,占日需铁总量的5% ,来源于食物中的蛋黄、肝、豆类、菠菜及铁制炊具游离出来的少量铁。内源性铁指来自红细胞在体内破坏后释放的铁,每天约21mg,占日需铁量的95%。衰老的红细胞被巨噬细胞吞噬后,血红蛋白被分解而释放出血红素中的铁,以Fe3+的形式与铁蛋白(ferritin)结合,聚集成铁黄素颗粒,贮存于巨噬细胞内。与铁蛋白结合的Fe3+,先还原成Fe2+,再脱离铁蛋白,然后与血浆中的转铁蛋白(transferrin)结合。每分子转铁蛋白能运送两个Fe2+到幼红细胞,转铁蛋白可来往于巨噬细胞与幼红细胞之间反复运送铁。此外,还可以通过巨噬细胞与幼红细胞的直接接触,提供合成血红蛋白所需的铁。由于慢性出血等原因,体内贮存的铁减少或造血功能增强而供铁不足,都可使血红蛋白合成不足,引起小细胞低色素性贫血(microcytic hypochromic anemia),又称为缺铁性贫血(iron-deficiency anemia)。
2.影响红细胞成熟的因素
在幼红细胞的发育过程中,细胞核的DNA对于细胞分裂及血红蛋白合成有着十分重要的作用,合成DNA必须有维生素B12和叶酸作为合成核苷酸的辅因子。当机体缺乏维生素B12或叶酸时,骨髓中幼红细胞DNA合成受阻,分裂增殖能力降低,发育成熟减慢,但胞浆RNA合成不受影响,胞浆成分(包括血红蛋白)形成相对较多,导致幼红细胞体积增大、寿命缩短、功能降低,由此导致的贫血,称为巨幼红细胞性贫血(megaloblastic anemia)。
(1)维生素B12 维生素B12(vitamin B12)是一种含钴的分子,也称钴胺素(cobalamin),主要存在于动物食品中(如肉、肝、肾等),人体的日需量为(1~3)μg,而人体的贮存量约为(1~3)mg。若维生素B12吸收障碍,常在3年~4年后才引起贫血。维生素B12在消化道的吸收与胃腺壁细胞分泌的一种糖蛋白-内因子(intrinsic factor)密切相关。内因子有两个特异性结合部位:一个部位与维生素B12结合形成内因子-维生素B12复合物,防止维生素B12被消化酶破坏,使其安全地运到回肠;另一个部位与回肠粘膜上皮细胞膜上的特异受体结合,促进维生素B12被上皮细胞吸收而进入门脉系统血流。被吸收的维生素B12,一部分贮存在肝,一部分又与转钴蛋白II(transcobalamine II)结合,随血流运送到造血组织,参与红细胞生成过程。当胃大部分被切除或萎缩性胃炎时,机体缺乏内因子,可导致维生素B12吸收障碍,发生巨幼红细胞性贫血。
(2)叶酸 叶酸(folic acid)广泛存在于动植物食品中,如动物内脏、蔬菜等,以蝶酰单谷氨酸的形式进入小肠粘膜上皮细胞,在双氢叶酸还原酶的催化下,形成四氢叶酸。在血浆中以四氢叶酸和单谷氨酸盐的形式存在,进入组织细胞后,转变为多谷氨酸盐,才具有参与DNA合成的活性。叶酸的活化需要维生素B12的参与,因此,维生素B12缺乏时,叶酸的利用率下降,可引起叶酸的相对不足。叶酸吸收障碍可在2个月~7个月内导致叶酸缺乏,也引起与维生素B12缺乏时相似的巨幼红细胞性贫血。
3.红细胞生成的调节
正常情况下,红细胞的生成与破坏保持动态平衡,血液中的红细胞数量相对恒定。成年人体内约有25×1012个红细胞,每24小时约有0.8%的红细胞更新,也就是说每24小时约有20×1010个红细胞生成;当机体需要时(如失血),红细胞的生成率还能加快数倍。目前已知,爆式促进因子(burst promoting activator,BPA)、促红细胞生成素(erythropoietin,EPO)、GM-CSF、IL-3、雄激素和甲状腺激素等,都能促进红细胞的生成和向外周血释放,其中BPA和EPO是促进红细胞增殖与分化的两个主要因子。在红细胞的分化和发育过程中,红系定向祖细胞阶段还可分为两个期:早期的红系定向祖细胞称为爆式红系集落形成单位(burst forming unit-erythroid,BFU-E),这是因为它们在体外培养中能形成很大的细胞集落,组成集落的细胞散布成物体爆炸的形状;晚期的红系定向祖细胞称为红系集落形成单位(colony forming unit-erythroid,CFU-E),在体外培养中只能形成较小的集落。BPA是一类分子量为25 000~40 000的糖蛋白,作用于BFU-E,可能是促进BFU-E从细胞周期中的静息状态(Go期)进入DNA合成期(S期),从而使BFU-E增殖活动加强,CFU-E对BPA不敏感。EPO是分子量为34 000的糖蛋白,含有166个氨基酸。EPO主要促进CFU-E增殖并向形态可识别的前体细胞分化,也能加速前体细胞的增殖、分化并促进骨髓释放网织红细胞,还能促进BFU-E的增殖与分化。EPO主要由肾皮质管周细胞(如成纤维细胞、内皮细胞等)产生(约占90%),用分子生物学方法从肾组织细胞中已提取出编码EPO的mRNA,并已确定EPO基因定位在7号染色体上;其次,肝也生成少量EPO,约占10%。因此,晚期肾病患者,肾产生EPO已基本停止,但体内仍有小量EPO促使骨髓继续产生红细胞。现在已知,EPO的生成受多种因素的影响,其中最主要的是缺氧。当心脏泵血功能下降、肺部疾患、贫血、高原缺氧等因素导致组织中氧分压降低时,都引起EPO生成增加,使骨髓中红系定向祖细胞和前体细胞增殖,红细胞生成增加,故EPO调节红细胞生成的反馈环,使血中红细胞数量保持相对稳定(图3-8)。关于缺氧诱导EPO产生的机制,新近的研究发现,在EPO基因的3'端存在低氧诱导增强子,5'旁侧序列上含有多个转录因子的结合位点,这些顺式调节元件和细胞核内反式作用因子特异性结合,从而增强EPO基因表达。目前,重组的人EPO已经应用于临床,治疗慢性肾功能衰竭的贫血、恶性肿瘤贫血和再生障碍性贫血等疾病,以促进红细胞生成。
(五)红细胞的破坏
红细胞由骨髓释放到血液后,平均寿命约为120天,在血管内循环流动约27km。成熟红细胞没有细胞核、线粒体、内质网等结构,但是胞浆中有酶系统存在,它们发挥如下作用:① 进行葡萄糖无氧酵解等代谢过程,生成三磷酸腺苷(adenosine triphosphate,ATP);② 保持细胞膜的柔韧性;③ 保证细胞膜的离子转运;④ 维持细胞内血红蛋白中的铁为二价铁,因为血红蛋白中的铁会自动氧化为三价铁,成为高铁血红蛋白(methemoglobin),从而失去结合氧的能力;⑤ 防止红细胞内蛋白质的氧化。当红细胞逐渐衰老时,胞浆内的酶系统活性逐渐降低,红细胞通过微小孔隙也发生困难,因而特别容易被滞留在脾、肝和骨髓中,被巨噬细胞所吞噬(血管外破坏);红细胞变形能力减弱而脆性增加,在血流湍急处可因受机械冲击而破损(血管内破坏)。
在脾内被吞噬的衰老红细胞被消化后,铁可再利用,而脱铁血红素也转变为胆色素,运送到肝进行处理。红细胞在血管内破损,即发生溶血,所释放的血红蛋白与血浆中的触珠蛋白(haptoglobin)结合,被肝脏的Kupffer细胞吞噬,血红素脱去Fe2+转变为胆色素,铁则以铁黄素(hemosiderin)的形式沉着于肝细胞内。但当溶血达到每100ml血浆中有100mg血红蛋白时,血浆中的触珠蛋白已不够用,未能与触珠蛋白结合的血红蛋白将经肾排出。
三、白细胞
(Leukocytes)
(一)白细胞的数量与分类
白细胞是一类有核的血细胞,在血液中一般呈球形,在组织中则有不同程度的变形。正常成年人白细胞数约(4.0~l0.0)×109/L;当白细胞数量超过l0×109/L时,称为白细胞增多(leukocytosis);少于4.0×109/L时,称为白细胞减少(leukopenia)。白细胞总数存在着明显的生理性波动,进食、疼痛、情绪激动、妊娠等都可使白细胞总数升高。白细胞是一个不均一的细胞群,根据其形态、功能和来源可分为粒细胞(granulocytes)、单核细胞(monocytes)和淋巴细胞(lymphocytes)三大类。其中,粒细胞根据胞浆颗粒的嗜色性质不同又分为中性粒细胞(neutrophil)、嗜碱性粒细胞(basophil)和嗜酸性粒细胞(eosinophil)三种(表3-2)。
表3-2 血液中各种白细胞的正常值和主要功能
绝对值(×109/L) 百分比(%) 主要功能
粒细胞 中性粒细胞 嗜碱性粒细胞 嗜酸性粒细胞单核细胞淋巴细胞 2.0~7.50.0~1.00.02~0.50.12~0.80.8~4.0 50~700~10.5~53~820~40 吞噬功能参与过敏反应抗寄生虫和抗过敏反应组织吞噬细胞特异性免疫反应
白细胞总数 4.0~10.0
相关热词搜索:血液
上一篇:第二章 细胞的基本功能
下一篇:第四章 血液循环
精彩图文
频道总排行
频道本月排行
- 158第十章 感觉器官的功能
- 146第五章 呼吸
- 75第八章 体温
- 42第六章 消化和吸收
- 37第一章 绪论
- 25第十三章 生殖
- 4第三章 血液
- 3第七章 能量代谢
- 3第九章 尿液的生成与排泄
- 2第十二章 内分泌系统
热门购物
评论排行
- 2011年临床执业医师考试实践技能真...(13)
- 腋臭手术视频(12)
- 2008年考研英语真题及参考答案(5)
- 节食挑食最伤女人的免疫系统(5)
- 核辐射的定义和单位(5)
- CKD患者Tm与IMT相关(5)
- 齐鲁医院普外科开展“喉返神经监护...(5)
- windows7激活工具WIN7 Activation v1.7(5)
- 正常微循环(5)
- 美大学性教育课来真的 男女上阵亲...(4)