HBsAg在自然病程中的变化与临床意义
2013-09-15 22:55:32 来源:37度医学网 作者: 评论:0 点击:
“在乙型肝炎流行的亚太地区,有效治疗慢性乙型肝炎(CHB),除疫苗及药物外,还须依赖多种乙型肝炎相关检测。
在过去几年中,我们已经可利用高度敏感性及特异性的方法来定量检测血清中的病毒载量,并成功确认其能影响乙型肝炎病毒(HBV)感染的自然病程及治疗。
近年,乙型肝炎病毒表面抗原(HBsAg)定量检测的发展更进一步弥补HBV DNA浓度检测在低病毒载量患者中的不足。唯有广泛及有效地利用病毒学及血清学指标,才能使CHB的管理更臻理想。”
HBV的流行现状及传播途径
全球约有3.5亿HBsAg携带者,其中6000万人可能最终死于肝癌,4500万人死于肝硬化。据估计,每年约有l00万人死于CHB及其并发症。
自从1984年台湾地区开始施行新生儿乙型肝炎疫苗注射后,成果良好,学龄前儿童HBsAg携带率已由疫苗接种前的10%,大幅降至目前的1%以下,同时儿童肝癌的年发生率亦有显著下降。但据2007年最新统计结果,台湾地区仍有17.3%的成年人(>20岁)为HBsAg携带者(约300万人)。研究显示, 肝硬化与慢性肝炎相关死亡位居2012年台湾地区十大死因第9位,肝癌在癌症死因中居第2位。
HBV传播途径包括围产期垂直感染、体液传染(如输血、性行为等)以及器官移植等,潜伏期约为40~180天(平均60天)。
HBV结构及其功能
HBV隶属于肝脱氧核糖核酸病毒科,是一个42纳米大小的双层颗粒,外层是病毒外套膜(表面蛋白),内层为病毒的核鞘蛋白(病毒DNA及病毒聚合酶)。
1963年,美国学者布隆贝格(Blumberg)等人首次在澳大利亚原住民血清中发现澳洲抗原,后来证实此抗原即为HBsAg。
HBV隶属于肝脱氧核糖核酸病毒(Hepadnaviridae)科。在电子显微镜下,其病毒颗粒是一个42纳米大小的双层颗粒,外层是病毒的外套膜,其上有表面蛋白。内层是病毒的核鞘蛋白,由核心蛋白组成。
核鞘蛋白包含病毒DNA及病毒聚合酶。HBV DNA是一种特殊的部分双股松环结构,包括一条完整的负股DNA以及一条不完整的正股DNA。其基因组有3200个碱基对,含有4个开放阅读框架(ORF),分别转录翻译病毒的表面抗原、核心抗原和e抗原(HBeAg)、聚合酶及X蛋白(HBx)。
HBV表面蛋白有3种,依分子量大小分别为大表面蛋白、中表面蛋白和小表面蛋白,其中小表面蛋白即HBsAg。
HBV核心蛋白及HBeAg均由前核心开放阅读框架转录和翻译而成。核心蛋白即核心抗原(HBcAg),在形成后组成核心颗粒。
HBeAg为分泌型蛋白质,在病毒大量复制时被释放至血液中,可以作为病毒大量复制时的血清学标记。
病毒的聚合酶是一个多功能的酵素,具有DNA聚合酶、反转录酶以及RNA分解酶等功能。
X蛋白的功能,目前认为与调控宿主细胞的讯息传递及病毒基因的转录有关,同时也可能是诱发肝癌的一个辅因子。
HBV的免疫致病机制
HBV本身并不具细胞毒性,其导致的肝细胞损伤和临床上的肝炎症状主要是因宿主免疫反应所致。
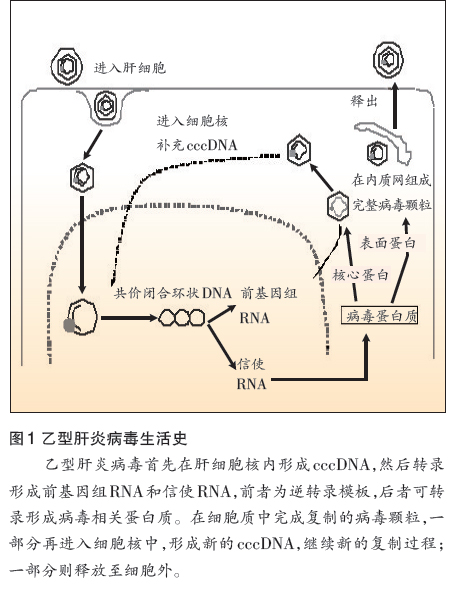
HBV感染宿主后,首先通过肝细胞表面受体进入肝细胞,之后在细胞核内完成双股DNA复制,同时形成共价闭合环状结构(cccDNA),再以cccDNA为模版转录出两种RNA:其一为前基因组RNA(pgRNA),做为后续反转录的模版;其二为信使RNA(mRNA),用以转录、翻译各个病毒蛋白质。这两种RNA在合成后被释放至细胞质。
pgRNA先被病毒核心颗粒包裹,在其中进行反转录。完成DNA复制的病毒颗粒,一部分重新回到细胞核中,形成新的cccDNA,继续新一轮的病毒复制;另一部分则在内质网与表面蛋白结合,形成完整的病毒颗粒,被释放至细胞外(图1)。
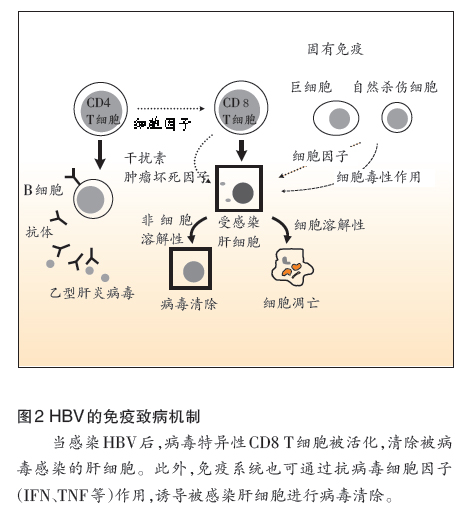
一般而言,HBV本身并不具细胞毒性,其导致的肝细胞损伤和临床上的肝炎症状主要是因宿主免疫反应所致。免疫系统对病毒的清除分为细胞溶解(cytolytic)和非细胞溶解(non-cytolytic)两种机制。前者通过病毒特异性T细胞,引发受感染肝细胞凋亡,肝细胞坏死时释放的细胞内酵素,可导致血清丙氨酸氨基转移酶(ALT)升高。后者则通过抗病毒细胞因子[如干扰素γ(IFN-γ)和肿瘤坏死因子α(TNF-α)]诱发受感染肝细胞进行病毒清除。当T细胞反应不全且无法清除病毒时,会导致慢性HBV感染。此外,机体自身的免疫系统同样可通过类似的机制协助机体抵御病毒(图2)。
慢性乙型肝炎(CHB)的病程分期
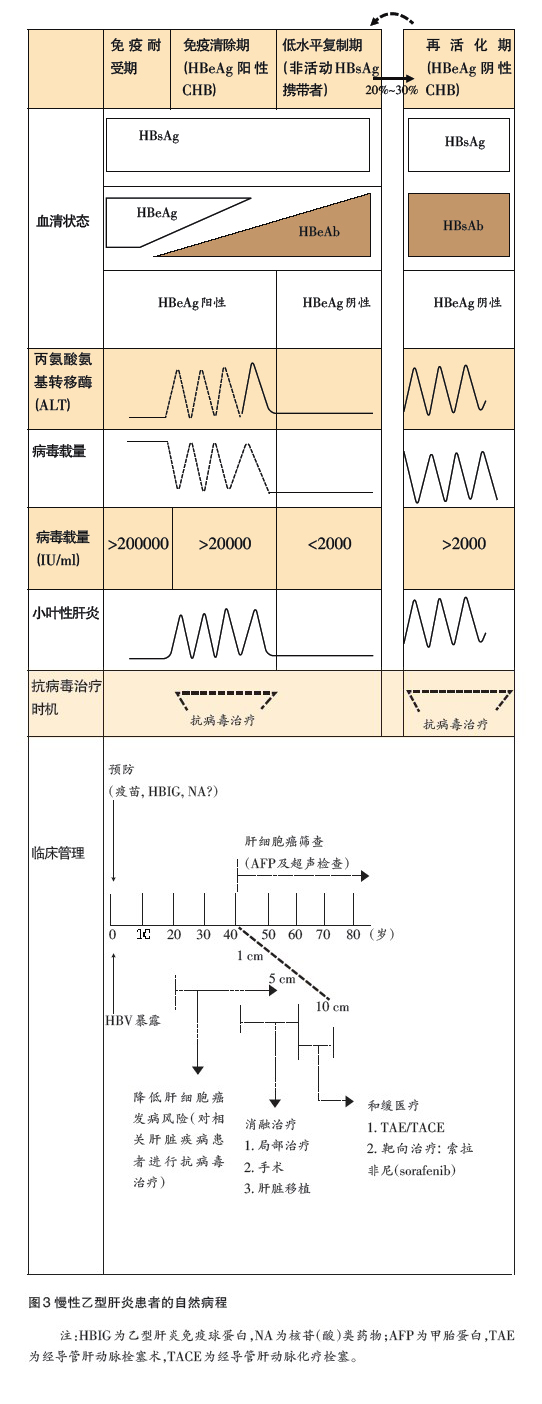
CHB的病程是相当多变复杂的,根据患者血清乙型肝炎病毒表面抗原(HBsAg)的有无、血清病毒DNA的效价及其肝功能的变化,临床上可将其分成免疫耐受期、免疫清除期、不活动携带期和HBeAg阴性CHB 4个阶段(图3)。
免疫耐受期(Immune tolerance phase)
此期患者HBsAg呈阳性,血清中病毒DNA载量很高,但患者丙氨酸氨基转移酶(ALT)可能正常或仅轻微升高,肝组织中亦无明显的炎性改变。
此时期最常出现在围产期垂直感染的儿童或年轻成人。
免疫清除期(Immune clearance phase)
慢性乙型肝炎病毒(HBV)携带者进入青春期后,体内免疫系统开始活化,从原本的免疫耐受期进入病毒清除期,血清中ALT上升,甚至出现急性肝炎的症状。
因此,此期又被称为乙型肝炎病毒e抗原(HBeAg)阳性慢性乙型肝炎(HBeAg-positive chronic hepatitis B)。
非活动HBsAg携带期(Inactive carrier state)
随着病毒的清除,大部分患者HBeAg转为阴性(HBeAg seroconversion),甚至出现乙型肝炎病毒e抗体(HBeAb)。此时患者的肝功能恢复正常,尽管HBsAg阳性,但HBeAg阴性,血清中的病毒载量很低,临床上称为非活动HBsAg携带期。通常,此时期是一个良性的病程,但也有部分患者在经过一段时间后自发性地或因免疫抑制而引发HBV再活化(reactivation)。
HBeAg阴性CHB(HBeAg-negative chronic hepatitis B)
约三分之一的不活动携带期患者会发生肝炎再活化(ALT和病毒载量升高),却没有出现HBeAg的再现,我们便称之为“HBeAg阴性CHB”。
此时期与某些病毒突变的产生有关,如前核心(precore)或核心启动子(core promoter)的突变,临床上血清ALT和病毒载量可出现波动。
整体而言,约有三分之一的慢性HBV感染患者处于慢性肝炎阶段,而不论HBeAg阳性或阴性,每年约有10%的CHB患者进展为肝硬化。一旦发生失偿性肝硬化或肝细胞癌(HCC),患者死亡率高达50%。
因此,对所有CHB患者,我们建议积极、适时地给予抗病毒药物,以遏止肝功能恶化,进而避免或延缓肝硬化或癌症等并发症的发生。
HBsAg定量检测在慢乙肝自然病程中的应用
目前有研究显示,血清HBsAg浓度与病毒清除的概率和肝癌发生风险密切相关,这提示HBsAg浓度对预测乙型肝炎患者长期的预后十分重要。
随着CHB自然病程进展,血清HBsAg浓度逐渐降低。横断面研究表明,CHB患者免疫耐受期HBsAg浓度最高(4.5~5.0 log10 IU/ml),而进入免疫清除期后,开始缓慢下降(3.0~4.5 log10 IU/ml),患者在经历HBeAg血清转换后, HBsAg浓度持续降低。如果属于不活动携带者,其HBsAg浓度最低(1.5~3.0 log10 IU/ml);如果患者发生HBeAg阴性的慢性肝炎,则HBsAg浓度可略高(2.5~4.0 log10 IU/ml)。
一项亚洲长期随访的队列研究表明,对于感染HBV基因型B或C的患者,HBsAg浓度越低,日后将其清除的概率就越高。
同时,台湾地区的一项研究指出,对于HBeAg阴性的患者,若HBsAg浓度下降至10 IU/ml,则其HBsAg消失的概率可从1%~2%升至7%。
另外,一项欧洲的长期随访的队列研究也表明,对于感染HBV基因型D的患者,当其HBsAg浓度<1000 IU/ml,HBV DNA 浓度<2000 IU/ml时,能有效区分不活动携带者(阳性预测率为90%,阴性预测率为97%)。
最近一项台湾地区的队列研究也指出,对于HBeAg阴性且HBV DNA浓度<2000 IU/ml的患者,若HBsAg≥1000 IU/ml,则其发生肝癌的风险比是HBsAg<1000 IU/ml者的13.7倍(95% 可信区间为4.8~39.3)。因此,血清HBsAg浓度对预测乙型肝炎患者长期预后相当重要。
上一篇:从HBsAg的发现过程中,我们能够学到什么?
下一篇:HBsAg定量在抗病毒治疗中的意义
频道总排行
频道本月排行
热门购物
评论排行
- 2011年临床执业医师考试实践技能真...(13)
- 腋臭手术视频(12)
- 2008年考研英语真题及参考答案(5)
- 节食挑食最伤女人的免疫系统(5)
- 核辐射的定义和单位(5)
- CKD患者Tm与IMT相关(5)
- 齐鲁医院普外科开展“喉返神经监护...(5)
- windows7激活工具WIN7 Activation v1.7(5)
- 正常微循环(5)
- 美大学性教育课来真的 男女上阵亲...(4)