灰色血小板综合征研究进展
2012-07-18 16:30:56 来源:37度医学网 作者:宣旻 杨仁池 评论:0 点击:
灰 色血小板综合征( gray platelet syndrome,GPS)又称α贮存池病,是一种罕见的遗传性出血性疾病,因瑞氏染色后增大的血小板在光镜下呈灰色而得名。本病以血小板α颗粒及其所含 蛋白质减少或缺失为特征。临床上以轻中度出血为主要表现,常伴有血小板减少、脾肿大及骨髓纤维化等。GPS发病率很低,因而相关研究较少。早期的相关文献 多囿于对其进行临床分析、超微结构以及生化改变方面的研究。近年来由于基因检测技术的发展,其发病机制的研究取得了突破性进展。
一、 GPS的发病机制研究进展
1. 正常血小板α颗粒结构与功能:
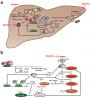
正常血小板内除δ颗粒(又称为致密颗粒)、溶酶体及过氧化物酶体外,还有一种特殊的α颗粒。在电镜下观察,α颗粒内容物多为中等电子密度、部分体积较小且含有密度较高的核(可能为小α颗粒前体)。
正常的α颗粒内有大量的可溶性蛋白,包括凝血因子V、凝血因子Ⅷ、血管假性血友病因子(VWF)、P选择素( CD62P)、纤连蛋白(FN)、血小板衍生生长因子(PDGJF)、转化生长因子β( TGFβ)以及凝血酶敏感蛋白(TSP)等[1]。另外还包含血小板第4因子(PF4)和β-血小板球蛋白(β-TG)等血小板特异性蛋白。近期有文献报道血小板内可能还存在着含不同蛋白质甚至不同释放机制的α颗粒亚群[2]。
一般情况下血小板α颗粒蛋白的合成方式有内源性合成和内吞途径2种。大部分颗粒蛋白如PF4、VWF、FN、纤维蛋白原等合成属于前者,而白蛋白和IgG的合成则属于后者。
血小板的α颗粒及其内容物在止血过程中发挥重要作用。血小板黏附时,先释放δ颗粒中钙、血清素、二磷酸腺苷(ADP)、5-羟色胺等非蛋白小分子以启动血小板聚集,随后释放α颗粒贮存的大量蛋白质促进血小板黏附。
2. GPS患者血小板α颗粒的异常
电镜下可见GPS患者血小板的高尔基区内有大量致密物质及碎片沉积,巨核细胞的高尔基区则正常。此外血小板内可见明显的α颗粒缺失,空泡内含有大量的致密物质。前体α颗粒和δ颗粒数量和形态完全正常。
进一步检测GPS患者血小板的蛋白质,显示PDGF、TSP及纤维蛋白原均显著降低。溶酶体酶、腺嘌呤核苷酸、5-羟色胺、过氧化酶的水平和环氧化酶或脂氧化酶转化花生四烯酸的能力均在正常范围内。另外,Falik-Zaccai等[3]对GPS患者的皮肤进行活检研究,发现其中贮存和释放VWF、CD62P、CD63等活性蛋白的管一棒状小体(Weib。l—Palade body,WPB)正常。
因此,目前认为GPS病变仅限于巨核细胞、血小板α颗粒及颗粒蛋白,而血小板内的溶酶体颗粒、δ颗粒、线粒体及过氧化物酶小体等细胞器均未累及。但也 有文献报道在同一家族3例GPS患者的瑞氏染色血片中可见灰色中性粒细胞,电镜证实其次级颗粒有缺陷,原因可能涉及蛋白靶向、颗粒构成、蛋白酶解、膜生成 或破坏等过程的异常[4]。
根据α颗粒蛋白合成途径的特点,Rosa等[5]应 用ELISA方法发现GPS患者的α颗粒中白蛋白及IgG含量接近正常,而PF4、β-TG、VWF、Ⅷ因子相关抗原(factor Ⅷ related anti-gen,FⅧR:Ag)等均显著减少。由此推测(GPS患者以α颗粒蛋白内源性合成异常为主。但也有研究者认为目前尚不了解蛋白质如何进入正常 或异常巨核细胞,或许GPS中α颗粒蛋白的合成方式不同于已知的内源性或内吞途径。关于α颗粒蛋白质进入颗粒的机制,Rindler[6]推测此过程可能与某种特异性信号相关,它能作用于多种可溶性蛋白并使之聚集于新生α颗粒附近。这种聚集过程可以同时进行,从而能保证某一细胞中形成多种分泌颗粒。 Smith等[7]在GPS患者的幼稚巨核细胞中检测到VWF、PDGF和PF4,但成熟巨核细胞中却无此类颗粒蛋白。其后Gerrard等[8]证 实GPS的血小板α颗粒中PF4及β-TG重度减少(低于正常值的10%),但胞质中PF4却有增高。由于上述蛋白质均由巨核细胞持续分泌而非外源性的, 因此推测GPS患者血小板的α颗粒缺陷可能是在巨核细胞成熟早期、正常合成的颗粒蛋白在其分隔膜处装配错误或遗失所致。
Maynard等[1]研究显示GPS患者血小板膜结合颗粒蛋白的肽段数正常,仅CD62P和葡萄糖转运蛋白(Glut3)稍低。其后Rosa等[5]利用CD62P抗体和免疫电镜技术,证实GPS患者的膜蛋白CD62P不仅能在静止的α颗粒膜上正常表达,而且经凝血酶刺激后也能转位至血小板质膜表面重新分布。推测α颗粒膜不仅能被正常合成,而且可在血小板内容物释放过程中与质膜正常融合。
由此可见,虽然GPS的内源性蛋白显著减少,但空泡外膜蛋白及很多重要的内吞来源蛋白却维持正常,因而推测膜蛋白和可溶性蛋白进入α颗粒的途径可能不同。但近期Nurden等[9]认 为尽管CD62P表达正常,但与之共存的膜糖蛋白髓系细胞触发样受体转录因子( TLT)-1可能是GPS潜在的致病靶点。TLT-1是一种仅表达于巨核细胞系的髓系细胞触发受体( rrREM)家族蛋白,与CD62P共同位于α颗粒膜上,它不仅可以转运α颗粒,而且能调节其收缩和分布,参与凝血酶诱导的血小板聚集试验[10]。但由于该实验的样本量少(2例中有l例TLT-1减少),目前尚不能定论。
3.GPS患者血小板α颗粒缺陷的分子机制
GPS是一种罕见的遗传性疾病,家系研究发现其多为常染色体隐性遗传,也有部分为常染色体显性或X连锁遗传,男女均可发病。 Raccuglia[11]于1971年首次报道GPS,随后报道的病例常伴随Goldenhar综合征、马凡综合征、糖蛋白(glycoprotein,GP)Ⅵ缺陷和TLT-1突变相关疾病等其他遗传异常,因此认为 GPS具有遗传异质性[12-13]。
GPS是一种罕见的遗传性疾病,家系研究发现其多为常染色体隐性遗传,也有部分为常染色体显性或X连锁遗传,男女均可发病。 Raccuglia[11]于1971年首次报道GPS,随后报道的病例常伴随Goldenhar综合征、马凡综合征、糖蛋白(glycoprotein,GP)Ⅵ缺陷和TLT-1突变相关疾病等其他遗传异常,因此认为 GPS具有遗传异质性[12-13]。
由于GPS患者可见多种蛋白同时缺失,因此早期即推测其病因可能为某种调节α颗粒蛋白合成的基因异常,或是与结合或组装相关的颗粒膜或磷脂成分的基因异常。但对于GPS致病基因的定位研究,却经历了一番波折。DiPaola等[13]。成功利用锌指蛋白(Hzf)和Rab27缺陷小鼠建立了CPS动物模型,Benit等[14]曾在5例患者中进行同源人ANF385a的基因测序,但均未检出此变异。Tubman等[15]曾 对一个X-连锁遗传的GPS家系进行研究,发现男性患者具 有普通GPS患者特征(轻度出血倾向、较大血小板和血小板减少),而无明显症状的女性致病基因携带者外周血涂片中可见正常血小板和灰色血小板共存。由于 男性患者同时还伴有轻度红细胞异常,因此研究人员将X染色体的变异域缩小于G10578及DXS6797之间,最终证实珠蛋白转录因子 ( GATA)-1(Arg216Gln)突变与GPS相关,且推测GATA1是GPS血小板α颗粒形成的上游调节基因。但Balduini等[16]认 为这些受试对象同时合并地中海贫血,属于一种GATA-1相关的血小板减少伴红细胞生成异常性疾病,于是提出虽然 某些鼠或人的基因缺陷确实可致GPS样临床表现,但不能就此证实经典的X连锁GPS是由上述单基因改变所致。因此 对于GPS的致病基因定位研究需要进一步考虑GPS的遗传 异质性。
近期一项关于常染色体隐性遗传GPS的研究涉及多种族14个家族共25例患者,首次将致病基因定位于染色体3p21,但是具体突变位点尚难确定,推测其可能位于启动子 或其他调节区域[17]。Fabbro等[18]也证实了隐性遗传GPS致病基因位于该染色体,并进一步将其范围缩小至1.7Mb内。其后Albers等[19]对4个无关家族患者进行了DNA基因 组序列分析,证实3号染色体上的NBEAL2(编码neu- robeachin-like2)突变是隐性遗传GPS的主要致病原因,它可以编码一种含BEACH结构域的蛋白质。Gunay-Aygun等[20] 进一步研究发现巨核细胞和血小板(尤其是血小板致密管道 系统)表达一种特异的NBEAL2转录本组合(NBEAL2-001、201/003、203/004、202),编码含BEACH/ARM/WD4域 的致病蛋白。此基因突变与患者出血严重程度、骨髓纤维化以及脾脏肿大无明显相关性。巨核细胞NBEALS2突变导致α颗粒缺陷的中间环节尚不明确。这种由 NBEAL2编码的蛋白质属于一种含ARM、BEACH及WD40结构域的蛋白质家族,这类高度保守的结构域对于蛋白间的相互作用、膜动力和空泡转运至关 重要。Kahr等[21]研究证实NBEAL2突变编码一种类似于溶酶体转运调节蛋白( lysosomal trafficking regula-tor,LYST)的多肽,可致Chediak-Higashi综合征(此病也同样伴颗粒蛋白合成及空泡转运受损)的δ颗粒缺陷,因此作者 推测GPS患者NBEAL2的突变可能通过影响α颗粒中空泡转运而致病。
二、GPS的临床研究进展
1. GPS的实验室特点
GPS患者外周血涂片经瑞氏染色后血小板呈灰白色卵圆形,较正常血小板稍大,常不易辨识。血常规检查常示血小板减少(但多高于50×l09/L),随患者年龄增大而加重[17]。目前尚不清楚该病患者血小板减少的病理机制。有研究显示GPS患者骨髓中巨核细胞虽有增多,但循环中血小板破坏产物糖盏蛋白( glycocalicin,GC)水平亦有升高,因此认为GPS患者的血小板减少很可能与其寿命缩短相关[22]。Kohler等[23]发 现糖皮质激素可在一定程度上提升GPS患者外周血血小板水平,因此推测机体免疫系统参与了血小板的破坏。另外,GPS患者出血时间延长,血小板第3因子可 正常或减少,血小板黏附功能减弱,花生四烯酸及瑞斯托霉素诱导的血小板聚集试验正常或接近正常,而ADP、肾上腺素、胶原或凝血酶诱导的血小板聚集试验结 果差异较大(可正常或减弱)。在凝血酶诱导的血小板聚集试验中,有研究发现凝血酶受体活化肽和正常数量的凝血酶PAR-1受体也能诱导异常的血小板聚集现 象[24]。因而是否因α颗粒蛋白缺乏或信号转导异常,亦或是两者共同导致血小板聚集异常尚不清楚。Enouf等[25]通过增加α颗粒空泡膜上的钙离子转运间接增加α颗粒蛋白,发现仍不能改善血小板的聚集能力,因此推测可能信号传导途径受损才是血小板聚集功能异常的主要原因。还有研究发现GPS患者的磷酸代谢、蛋白磷酸化、钙活化、血小板FVa或血小板分泌等存在异常。[24,26-27]。近期有报道GPS患者体内的维生素B[12]水平明显高于正常,但原因尚不清楚[17]。
2.GPS患者的临床表现、诊断和治疗
以往认为,GPS患者的临床症状多为皮肤黏膜出血,除非合并致命的颅内出血,一般出血症状较轻。但近来Gunay-Aygun等[17]报 道,尽管此病患者出血倾向各异,但仍有42%的患者出现严重出血,且与血小板的功能及减少程度无关。此外大多数患者还常伴有脾脏肿大和(或)骨髓纤维化。 脾脏肿大可能是髓外造血所致,骨髓纤维化则可能与巨核细胞合成的PDGF、TGFβ、PF4等促纤维化物质不能贮存于α颗粒而释放入髓有关[28]。有体外试验显示GPS患者的纤维母细胞过度表达FN,浓集于未产板巨核细胞间的胞外基质交界处而导致骨髓纤维化[29]。Jantune等[30]报道GPS患者随访15年骨髓纤维化程度未见明显进展。但近期有文献报道部分患者骨髓纤维化程度随年龄增长而进行性加重[17]。曾有GPS患者合并特发性肺纤维化的报道,推测可能与肺组织巨核细胞分泌的生长因子相关[31]。
临床上GPS需与免疫性血小板减少症、无纤维蛋白原血症、假性血管性血友病和血小板无力症等血小板功能异常性疾病相鉴别。骨髓增生异常综合征及骨髓增 殖性肿瘤也可出现血小板脱颗粒现象。除此之外,采用EDTA抗凝的正常人外周血涂片瑞氏染色后也可见到灰色血小板,但结合家族史及其他临床特征不难与本病 鉴别。
GPS目前尚无特异性治疗方案,主要以对症止血治疗为主。去氨加压素、抗纤溶药物、糖皮质激素以及脾切除术可能有一定疗效。
参考文献(略)
参考文献(略)
相关热词搜索:灰色血小板
上一篇:坏死性小肠结肠炎
下一篇:刘波:七步写出高水平SCI论文
频道总排行
频道本月排行
热门购物
评论排行
- 2011年临床执业医师考试实践技能真...(13)
- 腋臭手术视频(12)
- 2008年考研英语真题及参考答案(5)
- 节食挑食最伤女人的免疫系统(5)
- 核辐射的定义和单位(5)
- CKD患者Tm与IMT相关(5)
- 齐鲁医院普外科开展“喉返神经监护...(5)
- windows7激活工具WIN7 Activation v1.7(5)
- 正常微循环(5)
- 美大学性教育课来真的 男女上阵亲...(4)