溃疡性结肠炎综述
2011-11-17 09:17:12 来源:中国医学论坛 作者: 评论:0 点击:
西尔维奥·达内塞和克劳迪奥·菲奥基 意大利米兰市人类临床研究所胃肠病科等
19世纪中期有人首次描述了溃疡性结肠炎1, 而后来(1932年)有人首次报告克罗恩病为“局限性回肠炎”2。由于克罗恩病可累及结肠并具有与溃疡性结肠炎相同的临床表现,因此医师经常将这些病体合 并并诊断为炎性肠病(虽然它们是有明确不同病理生理的病体)。溃疡性结肠炎是全球最常见的炎性肠病类型。与克罗恩病不同,溃疡性结肠炎是一种黏膜疾病, (发生)并发症的倾向较小,并可通过结肠切除的方式治愈,并且在很多患者中,该病的病程为轻度3。关于所谓炎性肠病的发病机制和治疗的文献一直倾向于关注 克罗恩病4-7,并且很少文章特别地讨论溃疡性结肠炎8,9。我们在此就我们当前对迄今为止溃疡性结肠炎病理生理学、诊断和治疗的了解进行综述,我们还比 较了溃疡性结肠炎与克罗恩病,并根据情况将两者都称为炎性肠病。
发病机制
流行病学特征
溃疡性结肠炎和克罗恩病是现代社会的疾病,并且自20世纪中期以来它们的发生率在发达国家不断升高。当在一个新人群识别炎性肠病时,溃疡性结肠炎总是 先于克罗恩病出现,并且发病率更高。溃疡性结肠炎的发病率为每年1.2~20.3例/10万人,并且其患病率为每年7.6~246.0例/10万人,相比 之下,克罗恩病的发病率为每年0.03~15.6例/10万人和患病率为每年3.6~214.0例/10万人10。然而,在儿童中,溃疡性结肠炎较克罗恩 病少见11。炎性肠病的最高发病率和患病率见于北欧和北美的人群,而最低(发病率和患病率)见于亚洲大陆,在该地区,溃疡性结肠炎是迄今为止最常见的炎性 肠病类型12。西方化环境和生活方式与炎性肠病的出现有关联,该病与吸烟、高脂和高糖饮食、用药、应激以及高社会经济状况相关13。炎性肠病还与阑尾切除 术相关13。在这些因素中,只有吸烟和阑尾切除术与溃疡性结肠炎重复关联。吸烟与疾病较轻、住院较少和药物需要减少相关14。在早年切除炎性阑尾与溃疡性 结肠炎发病率降低相关15,而克罗恩病的情况正好相反。
遗传特征
NOD2(基因)变异体与克罗恩病易感性相关这一发现开创了炎性肠病遗传基础研究的一个新时代16,17。在孪生子研究中,克罗恩病比溃疡性结肠炎存 在更强的一致性,在早期全基因组关联研究中大量克罗恩病易感位点的识别提示,遗传影响在克罗恩病所起的作用大于在溃疡性结肠炎所起的作用18。一项包括6 项这类研究的荟萃分析最近证实存在47个与溃疡性结肠炎相关的位点,其中19个为溃疡性结肠炎特异性以及28个与克罗恩病共有19。基于已被验证的位点或 染色体区的荟萃分析和个别研究识别出了数条可能与溃疡性结肠炎相关的通路20。ECM1、HNF4A、CDH1和LAMB1的危险位点涉及上皮屏障的功能 障碍,与DAP的相关性提示了与细胞凋亡和自噬的关联,以及与PRDM1、IRF5和NKX2-3的相关性提示了转录调节的缺陷。此外,多个白介素-23 信号转导通路的基因在溃疡性结肠炎和克罗恩病重叠(例如IL23R、JAK2、STAT3、IL12B和PTPN2)。数个与其他免疫系统介导的疾病有关 联的危险位点与溃疡性结肠炎相关,特别是HLA-DR和涉及1型和17型辅助性T细胞(Th1和Th17)分化的基因(例如IL10、IL7R、 IL23R和IFN-γ)。总之,遗传研究表明,特异性和非特异性基因变异体均与溃疡性结肠炎相关,并且这两种类型的炎性肠病有共同的通路。溃疡性结肠炎 似乎在遗传上和克罗恩病一样呈异质性,但考虑到涉及的基因数量多和每种基因的加性效应小,因此遗传筛查当前不适用于评估溃疡性结肠炎的危险。
微生物学特征
健康取决于有益的宿主-微生物相互作用。肠道健康也肯定如此,特别是在结肠。结肠拥有比任何其他器官更大量和更多样的微生物21。肠道免疫系统通常可 耐受这种微生物负荷,据推测,耐受性的破坏是炎性肠病发病机制的中心(环节)22。虽然对肠道微生物区系(microbiota)耐受性丧失已经在炎性肠 病动物模型中得到证明,但在克罗恩病患者这一结果只有有限的证据,并且在溃疡性结肠炎患者没有这一结果的证据。
还有人推测,肠道微生物区系组成的改变、黏膜免疫的缺陷或这两种因素综合可导致溃疡性结肠炎。然而,支持性证据稀少。鉴定正常肠道和炎性肠病患者肠道 中的肠道微生物区系是一个关键问题。这个问题等待着来自人类微生物组计划的答案,该计划旨在确定在健康和疾病条件下肠道微生物区系的组成23。目前有一个 共识是,溃疡性结肠炎或克罗恩病患者的微生物区系密度高于健康对照受试者,但是否有可重复的疾病特异性改变尚不清楚24。抗生素治疗对溃疡性结肠炎没有临 床效应这一事实不支持细菌在该病有重要作用,而抗生素的确可为肠腔克罗恩病提供一些益处25。虽然溃疡性结肠炎患者存在血清抗细菌抗体,但其在克罗恩病患 者更常见并且滴度更高。此外,在克罗恩病抗细菌抗原的抗体(抗-I2、抗OmpC和抗CBir1抗体)和抗真菌抗原的抗体[抗酿酒酵母抗体(ASCA)] 的范围更广,而唯一的溃疡性结肠炎相关抗体是核周抗中性粒细胞胞浆抗体(pANCA),该抗体可识别有可能与细菌抗原交叉反应的核抗原26。

黏膜免疫应答
肠道稳态需要一种对微生物区系的控制性固有免疫应答,这种应答由上皮和免疫细胞上的toll样受体(TLR)和核苷酸结合低聚反应结构域(NOD)样 受体识别27。这一识别过程导致耐受,但当该过程失调时,则接着发生炎症。目前,尚无溃疡性结肠炎有特异性固有免疫缺陷的明确证据,结肠细胞表达TLR2 和TLR4增加28很可能继发于炎症。相反,在克罗恩病,固有免疫异常与NOD2、ATG16L1和IRGM基因的变异体有关联,这些基因的产物在正常情 况下介导微生物识别16,17,29,30。在炎性肠病患者,促炎细胞因子[例如白介素-1β、白介素-6、肿瘤坏死因子 α(TNF-α)和肿瘤坏死因 子样配体1(TL1A)]的产生普遍增多,但这无法使我们区分溃疡性结肠炎与克罗恩病。
溃疡性结肠炎发生体液性和细胞性适应性免疫异常。IgM、IgA和IgG水平升高在炎性肠病常见,但溃疡性结肠炎有IgG1抗体(水平)的不成比例升 高31。可鉴别溃疡性结肠炎与克罗恩病的适应性免疫异常由黏膜CD4+T细胞确定,这些细胞初始分为2个细胞系:Th1和2型辅助性T细胞(Th2)。根 据干扰素-γ产生增多的证据,克罗恩病是一种Th1样病况32。相反,溃疡性结肠炎代表一种非典型Th2反应,表现为结肠存在分泌大量白介素-13(介导 上皮细胞的细胞毒性、细胞凋亡和上皮-屏障功能障碍)的非经典自然杀伤T细胞33,34。溃疡性结肠炎还存在产白介素-5的Th2极化T细胞。有人用 Th1和Th2之间的平衡来鉴别溃疡性结肠炎与克罗恩病。然而,其他辅助性细胞系(包括产生促炎细胞因子白介素-17的Th17细胞,而白介素-17的水 平在炎性肠病患者的黏膜升高)35最近已有描述。然而,尚未报告溃疡性结肠炎有T-细胞调节功能缺陷36。
上皮细胞和自身免疫
由于溃疡性结肠炎的炎症通常不延伸至小肠并且发生于上皮近端,因此该病的发病机制涉及结肠细胞。有人提出,无论是否存在炎症,(溃疡性结肠炎)上皮细 胞均为弥漫性异常37。在溃疡性结肠炎报告的其他异常包括上皮-屏障缺陷和过氧化物酶体增殖物激活受体γ(PPAR-γ)(一种调节炎症基因的核受体)的 表达损害38。在溃疡性结肠炎和克罗恩病,上皮细胞激活抑制性CD8+T细胞的能力均下降,但这种异常很可能继发于其他免疫事件39。XPB1基因(其产 物是上皮细胞内质网应激反应的一种成分)的变异体与炎性肠病有关联,从而加强了炎性肠病发病机制涉及结肠细胞这一观念40。
自身免疫有可能在溃疡性结肠炎(发病机制中)起作用。除了pANCA,这种疾病的特征还有:循环IgG1抗体抗一种结肠上皮抗原,这种抗原为结肠上皮 与皮肤、眼、关节和胆管上皮共有41。由于上述部位均为溃疡性结肠炎肠外表现的部位,因此针对结肠的交叉反应抗体可能会导致器官特异性损害。原肌球蛋白 5(一种结构蛋白)是IgG1抗体的假定靶自身抗原42,但在溃疡性结肠炎仍缺乏经典抗体介导的自身免疫的证据。图1总结了我们当前对溃疡性结肠炎发病机 制的了解。
临床表现
症状、临床病程和疾病活动性评估
有或没有黏液的血性腹泻是溃疡性结肠炎的特征。发病通常为渐进性,经常伴随周期性自发缓解和随后复发。活动性疾病表现为始于直肠的黏膜炎症(直肠炎) 以及在一些病例蔓延至结肠其余部分(补充附录中的图1A,其与本文全文均可从NEJM.org获取)。虽然直肠炎通常伴有排便急迫和排出鲜血,但有可能矛 盾地发生便秘。直肠乙状结肠炎、左侧结肠炎、广泛性结肠炎或全结肠炎(补充附录中的图1B)有可能导致腹泻、频繁排出血液和黏液、(排便)急迫或里急后 重、腹痛、发热、不适和体重减轻,这取决于疾病的范围和严重程度43。在左侧溃疡性结肠炎患者和直肠炎或直肠乙状结肠炎患者,可识别出阑尾开口周围的一小 片炎症区(盲肠斑)44(补充附录中的图1C),但这一结果并非特异性。溃疡性结肠炎患者的预后在诊断后头10年期间通常良好,结肠切除率低。随着时间的 推移,大多数患者发生缓解3。溃疡性结肠炎临床活动性的评估有助于临床医师选择诊断性检查并做出治疗决策。有人根据临床、实验室和内镜检查结果制定了各种 疾病活动性指数,但它们主要被用于临床试验45。
并发症
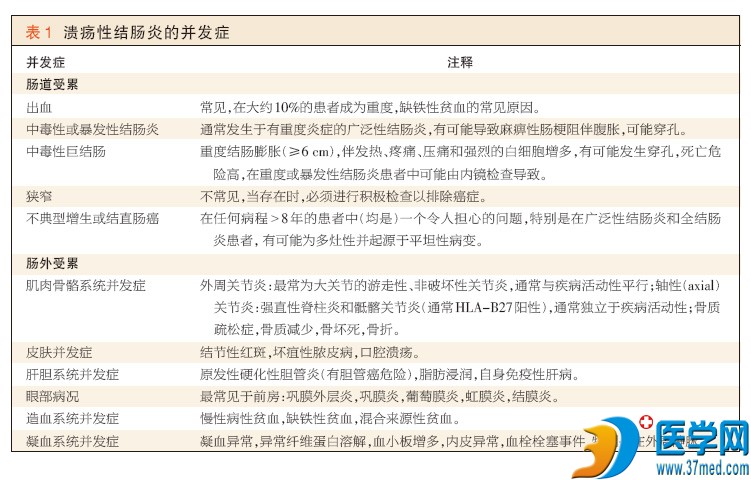
广泛性或重度炎症患者有可能发生急性并发症(例如重度出血和中毒性巨结肠)(补充附录中的图1D)。其他问题(例如上皮不典型增生或癌症)有可能在 (疾病)慢性期出现(补充附录中的图1E)。根据来自转诊中心的数据,在慢性溃疡性结肠炎患者中,结直肠癌的累积危险有可能在30年时达到 20%~30%46,但在基于人群的系列(研究)中,发病率要低得多(大约2%)47。癌症的危险因素包括:疾病持续时间长(无论临床活动性如何),广泛 受累,年轻发病,重度炎症,存在原发性硬化性胆管炎,以及结直肠癌家族史。虽然(医师)建议对有危险的患者进行监测性结肠镜检查,但尚无这种监测可延长 (患者)生存期的明确证据48。10%~30%的溃疡性结肠炎患者发生累及各器官和系统(例如关节、皮肤、肝、眼、口和凝血)的肠外表现,这些表现可先于 症状的发生,或与肠道表现平行出现和演变(表1)。
诊断
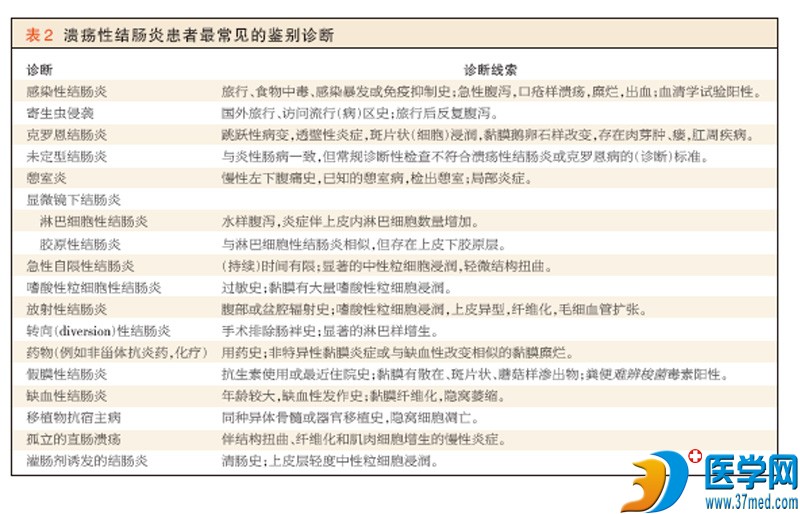
溃疡性结肠炎的准确诊断包括确定炎症的范围和严重程度,并且这一信息为选择最合适治疗和预测患者预后提供依据。需要同时进行内镜检查及活检以确定特异 性组织学特征。X线和超声检查并非关键但可能有用43。所有这些检查均有助于鉴别溃疡性结肠炎与其他有相似表现的病况(表2)。
内镜检查
结肠镜检查显示一处始于肛门直肠交界并向近端延伸的均匀炎性黏膜,并有从受累黏膜向正常黏膜的突然或逐渐转变。在轻度溃疡性结肠炎,黏膜有颗粒状、红 斑状外观,伴脆性以及血管模式丧失。在中度疾病,糜烂或微小溃疡明显,而在重度溃疡性结肠炎,通常可见浅溃疡伴自发性出血(补充附录中的图2A、2B和 2C)。在全结肠炎,炎症止于回盲瓣,偶尔有远端回肠的有限受累,这种病况称为倒灌性回肠炎49。结肠镜检查有助于鉴别溃疡性结肠炎与克罗恩病,后者通常 有以下特征:直肠不受累,口疮性溃疡,跳跃性病变(炎症区与正常黏膜交替出现),鹅卵石样模式以及纵向不规则溃疡。

在周期性出现炎症和愈合的患者以及在有慢性持续炎症的患者,结肠镜检查有可能显示假性息肉或黏膜桥接(补充附录中的图2D和2E)。如果检出狭窄,必 须取多份活检,以排除恶性疾病。在患病>8年的患者,也需要活检来监测不典型增生。虽然尚无监测可延长(患者)生存期的明确证据50,但应从所有结肠段采 集活检标本,无论它们是否有炎症,并特别注意不规则黏膜、息肉样病变和任何隆起性、不典型增生相关性病变或肿块51(补充附录中的图2F)。正在获得接受 的较新的内镜技术(例如色素内镜检查、窄带成像检查和自发荧光成像检查)有可能可更好地描述可疑的黏膜模式,并改善不典型增生的检测(补充附录中的图 2G)45,52,53。
组织学评估
在溃疡性结肠炎,炎症特征性地局限于黏膜层,在病变活动或缓解期,(细胞)浸润的密度和组成有变化(补充附录中的图3A和3B)。浸润主要由淋巴细 胞、浆细胞和粒细胞组成,后者在急性发作期特别显著,并聚积在隐窝脓肿中54(补充附录中的图3C)。其他典型特征包括杯状细胞缺失、隐窝结构扭曲、隐窝 密度降低和溃疡。然而,上皮样肉芽肿(这是克罗恩病的典型表现)不存在。考虑到长期溃疡性结肠炎患者的癌症危险,因此寻找上皮不典型增生很关键。然而,不 典型增生可发生于任何病期但不显示恶性转化(补充附录中的图3D)。溃疡性结肠炎尚无确切的诊断标准,但在大多数病例,存在2种或3种上述组织学特征将已 足以(诊断该病)55。组织学检查(显示)的炎症严重程度和内镜检查(显示)的疾病严重程度有可能不一致,例如,即使在内镜检查显示静止疾病的患者,组织 学结果也有可能显示重度疾病。
实验室检查
虽然实验室检测不具诊断性,但有助于评估和监测疾病活动性以及鉴别溃疡性结肠炎与其他类型的结肠炎。血(细胞)计数和红细胞沉降率的测量以及粪便乳铁 蛋白或钙防卫蛋白的水平有助于确定炎症的严重程度。有人建议通过粪便培养难辨梭菌、弯曲杆菌属和大肠埃希菌0157:H7来排除感染性原因或并发症。应通 过组织学、免疫化学、血清学、培养或DNA检测的方法评估重度、难治性疾病的患者(有无)巨细胞病毒感染56。ASCA或pANCA检测阳性不具诊断性, 因为这些检查的灵敏度和特异性有限。然而,当联合实施这些检测时,结果可能有助于鉴别溃疡性结肠炎、克罗恩病和未定型结肠炎57。未定型结肠炎累及大约 10%的患者,这些患者的结肠炎同时具有克罗恩病和溃疡性结肠炎的特征。
治疗
药物治疗
根据当前基于共识的指南,溃疡性结肠炎患者的治疗选择应考虑临床活动性水平(轻度、中度或重度),并结合疾病的范围(直肠炎、左侧疾病、广泛性疾病或全结肠炎)以及随访期间的病程和患者的意愿43,58,59。
诱导缓解
柳氮磺吡啶和5-氨基水杨酸类(美沙拉秦、奥沙拉秦和巴柳氮)经口服、直肠(以栓剂或灌肠剂的方式)或两种途径同时给药是溃疡性结肠炎的一线治疗,预 期缓解率约为50%60。轻至中度直肠炎可用美沙拉秦栓剂(1 g/d)或灌肠剂(2~4 g/d)治疗。大多数患者在2周内发生临床缓解,根据需要可重 复治疗。如果这种治疗失败,则5-氨基水杨酸灌肠剂(2~4 g/d)或糖皮质激素灌肠剂[氢化可的松,剂量为100 mg/d,或新制剂(例如布地奈德 或倍氯米松)]是下一步(治疗)61-63。对直肠给药没有反应的患者可能可给予口服糖皮质激素(最大40 mg泼尼松或其等效药物)。
轻至中度左侧结肠炎至广泛性溃疡性结肠炎初始最好用直肠和口服5-氨基水杨酸(最多4.8 g/d)联合治疗64。据报告,逐渐增加口服5-氨基水杨 酸的剂量通常可产生最好的临床反应65,并且每日1剂5-氨基水杨酸(2 g/d)或较新的控释剂型(例如多基质5-氨基水杨酸,2.4 g/d)一样有 效并可促进(患者的)治疗依从性66,67。直肠治疗和口服5-氨基水杨酸难治性轻至中度溃疡性结肠炎患者是口服糖皮质激素或免疫抑制剂(硫唑嘌呤或6- 巯基嘌呤)治疗的候选者。对最大剂量的5-氨基水杨酸或口服糖皮质激素没有反应的患者应给予静脉输注糖皮质激素59。对于持续需要糖皮质激素治疗的患者和 对这种治疗没有反应的患者,英夫利西单抗(一种抗TNF-α的单克隆抗体)似乎是一种好的治疗选择,在0、2和6周时使用,剂量为5 mg/kg体重 68。据报告,在中至重度溃疡性结肠炎患者,英夫利西单抗联合硫唑嘌呤(2.5 mg/kg)在诱导无糖皮质激素缓解方面优于英夫利西单抗或硫唑嘌呤单一 治疗69。
许多专家提出广泛性、重度疾病患者应接受一个5~7天疗程的静脉输注糖皮质激素治疗59。如果疾病(对治疗)没有反应,则静脉输注环孢素 (2 mg/kg)或英夫利西单抗通常是下一步(治疗)。虽然环孢素可能有效,但其通常只能延迟但不能防止以后的结肠切除术70。此外,英夫利西单抗正越 来越多地被用作难治性疾病患者的替代治疗,因为该药有效并且短期安全性谱好于其他治疗71,72。有人提出数种方案来确定在疾病(对治疗)无反应的患者是 否应实施结肠切除术。这些方案综合了大便次数,C-反应蛋白、白蛋白和粪便钙防卫蛋白的水平,以及X线和内镜检查结果73。复合指标似乎是最可靠的评估方 法,例如,牛津指标建议,如果C-反应蛋白水平>45 mg/ml并且如果患者每天排便3~8次和在开始静脉输注糖皮质激素或环孢素治疗后第3天(起)每 天排便>8次,则考虑结肠切除术73。
维持缓解
在获得缓解后,目标是维持无症状状态,这可通过各种药物来实现,糖皮质激素是例外,该药在维持治疗中没有地位,因为长期使用这些药物有显著的副作用。 口服和经直肠给予5-氨基水杨酸对远端疾病患者维持缓解的疗效均大于安慰剂74,75。当5-氨基水杨酸无效或不能耐受时或当患者依赖糖皮质激素时,建议 (使用)巯嘌呤类(例如硫唑嘌呤,剂量为2.5 mg/kg,或6-巯基嘌呤,剂量为1.5 mg/kg),虽然这些药物有可能需要几个月才能达到其最大 效应。在一项荟萃分析中76,硫唑嘌呤优于安慰剂,不良事件(包括急性胰腺炎和骨髓抑制)发生于>10%的患者。在一项包括糖皮质激素依赖患者的随机试验 中,用硫唑嘌呤治疗(获得)无糖皮质激素缓解的患者比例显著高于用5-氨基水杨酸治疗(53%对21%)77。已被广泛使用的巯嘌呤类与淋巴组织增生性疾 病的危险升高(但较低)相关(<1例/1000患者-年)78。对免疫抑制治疗无反应或不能耐受的患者可逐渐采用抗TNF-α药物。有人报告当在循 环中可以检出最低水平的英夫利西单抗时,内镜检查显示缓解和改善率较高,以及结肠切除率较低79。
与克罗恩病不同,溃疡性结肠炎有可能对益生菌治疗有反应。例如,大肠埃希菌Nissle 1917株(200 mg/d)对维持缓解的效果不低于5- 氨基水杨酸(1.5 g/d)80,而益生菌VSL#3(3.6万亿克隆形成单位/d,治疗8周)联合5-氨基水杨酸可能有助于在轻至中度溃疡性结肠炎患 者中诱导缓解81。
手术治疗
已报告的溃疡性结肠炎患者结肠切除率范围从<5%到>20%82,83。手术可能可治愈这类患者,但不能治愈克罗恩病患者。抗TNF-α药物的扩大使 用并未减少溃疡性结肠炎患者对结肠切除术的需要84。手术适应证有多种,包括药物治疗失败、顽固性暴发性结肠炎、中毒性巨结肠、穿孔、不可控制的出血、不 能耐受的药物副作用、无法用内镜缓解的狭窄、无法切除的高度或多灶性不典型增生、不典型增生相关性病变或肿块、癌症和儿童生长迟缓85。手术选择也有多 种。传统的直肠结肠切除术并回肠造口术为根治性并且技术简单,然而,(该手术的)可能并发症包括小肠梗阻、瘘、持续疼痛、性功能障碍和膀胱功能障碍以及不 育86,87。全直肠结肠切除术并回肠袋-肛门吻合术(IPAA)是当前大多数需要择期手术患者选择的术式,因为该术式有保留肛门括约肌功能的独特优点。 这种方法与可接受的并发症发生率(19%~27%)、极低死亡率(0.2%~0.4%)和良好术后生活质量相关88。自制性回肠造口术是不符合IPAA入 选标准或拒绝IPAA或IPAA没有帮助的溃疡性结肠炎患者的一种备选术式85。该手术从回肠构建一个带乳头阀门的袋,并将之连接至下腹部皮肤。这种手术 允许保留粪便,并在必要时通过一根导管排出。任何残留的结肠黏膜都可能癌变,因此要求进行长期内镜监测。
隐窝炎(IPAA最常见和临床上最有意义的远期并发症)是一种很可能由对回肠袋中新建立微生物区系的免疫应答导致的非特异性炎症(生态失调)89。隐 窝炎的发生率可高达40%,在10%~20%的病例,隐窝炎变为慢性。症状包括大便次数增加,排便急迫、失禁、渗漏,以及腹部和肛周不适。治疗主要由抗生 素(甲硝唑、环丙沙星或利福昔明)组成,而益生菌可能对预防复发有效90。8%~10%的患者发生(回肠)袋失效,这是一种需要袋切除或永久转向的情况 89。
未来挑战和新型治疗
溃疡性结肠炎通常容易诊断,并且传统的上阶梯治疗对管理轻至中度疾病活动性已足够。然而,各种重大的挑战仍然存在。数个关于溃疡性结肠炎发病机制的问 题仍有待回答。炎症为何仅局限于黏膜层?结肠上皮细胞是否为免疫应答的特异性靶点?肠腔内微生物区系如何与炎症反应相关? IPAA治疗的患者为何发生隐 窝炎?
考虑到恶性转化的可能性,在有长期溃疡性结肠炎和切除后残留黏膜的患者中进行不典型增生的监测和检测仍然关键。虽然重复结肠镜检查取多处活检是常规方 法,但尚需可靠的分子学生物标志物来区分进展为癌症的病例与不进展为癌症的病例91。黏膜愈合似乎是治疗效果的一个重要终点,其与复发率下降和癌危险可能 下降相关,但这一终点的定义、标准化和验证尚不完善92。
很多溃疡性结肠炎患者仍在接受次最佳剂量药物(特别是氨基水杨酸类)治疗,持续采用过长时间间隔的糖皮质激素治疗,或在免疫抑制治疗达到最佳效果之前 转为生物制剂治疗。在很多病例,结肠切除术是一种合理的选择,但由于个人意愿或尽管存在药物问题,患者和临床医师一样仍不愿意接受手术,即使长时间的补救 治疗可能弊大于利(特别是在生活质量和瘤形成的危险方面)。
在溃疡性结肠炎患者中生物制剂的使用时机正在接受评估—例如,在正在进行的试验评估抗TNF-α和其他生物制剂的疗效93(补充附录中的图2和表 1)。据报告,阿达木单抗(一种不同的抗TNF-α抗体)可诱导缓解94,而可防止白细胞归巢于肠道的抗体(例如MLN0002和PF- 00547659)已显示对活动性溃疡性结肠炎有初步疗效95,96。由于白介素-13似乎是溃疡性结肠炎的一种效应性细胞因子,因此白介素-13阻滞剂 的开发似乎合理,这一结论得到了最近一项研究的支持,该研究显示,在溃疡性结肠炎患者中使用干扰素β-1a可抑制白介素-13的产生97。在给予利妥昔单 抗消耗B细胞的患者中溃疡性结肠炎加重的报告提示,在评估新治疗时,小心谨慎至关重要98。在病程早期通过这类措施(例如干细胞治疗或联合免疫抑制治疗) 来改变溃疡性结肠炎的自然史是否可行仍是一个有待回答的问题。(完)
作者:吕国平
(N Engl J Med 2011; 365:1713-25. November 3, 2011) [7750101]
上一篇:乙肝定量存在的误区
下一篇:肝病成公务员第一职业病
频道总排行
频道本月排行
热门购物
评论排行
- 2011年临床执业医师考试实践技能真...(13)
- 腋臭手术视频(12)
- 2008年考研英语真题及参考答案(5)
- 节食挑食最伤女人的免疫系统(5)
- 核辐射的定义和单位(5)
- CKD患者Tm与IMT相关(5)
- 齐鲁医院普外科开展“喉返神经监护...(5)
- windows7激活工具WIN7 Activation v1.7(5)
- 正常微循环(5)
- 美大学性教育课来真的 男女上阵亲...(4)