浙大二院沈华浩团队揭示哮喘炎症治疗新靶点
2021-03-08 18:23:35 来源: 作者: 评论:0 点击:
关键字: 哮喘炎症治疗
2021年2月28日,浙江大学医学院附属第二医院呼吸与危重症医学科、浙江省呼吸疾病诊治及研究重点实验室沈华浩教授、应颂敏教授为共同通讯作者,在靶向治疗领域著名期刊Signal Transduction and Targeted Therapy(IF:13.493)上在线发表了题为“Eosinophil-derived chemokine (hCCL15/23, mCCL6) interacts with CCR1 to promote eosinophilic airway inflammation”的研究论文[1]。该研究在国际上首次构建趋化因子CCL6基因敲除小鼠,首次发现嗜酸性粒细胞通过CCL6-CCR1信号轴对哮喘炎症环路的正反馈调控新机制,并通过体外实验首次证实CCL6的受体为G蛋白偶联受体(GPCR)CCR1,靶向CCR1的治疗可以在体内外抑制嗜酸性粒细胞的分化和气道炎症,揭示了靶向CCL6-CCR1轴可用于哮喘临床治疗的新干预靶点。
支气管哮喘和趋化因子
支气管哮喘(简称哮喘)是最常见的慢性疾病之一,全球的哮喘患者有近4亿人,在我国已有6000多万的哮喘患者。哮喘的防治已经成为了重要的公共卫生与医疗保健问题,对哮喘疾病发病机制和治疗靶点的深入探究也至关重要。哮喘患者中,超过半数是由过敏性诱发的TH2细胞主导的2型免疫反应,包括嗜酸性粒细胞在内的多种免疫细胞组分都发挥了重要作用,其中嗜酸性粒细胞浸润、粘液高分泌和气道高反应性是其主要病理特征,但嗜酸性粒细胞调控过敏性炎症的关键机制尚未完全清楚。
趋化因子是一类小分子蛋白,作用于细胞表面的趋化因子受体。趋化因子受体是一类G蛋白偶联受体(GPCR),二者结合介导免疫细胞运输、调节炎症反应。在过敏性哮喘中,除了嗜酸性粒细胞趋化因子(Eotaxin)-CCR3等经典的调控机制以外,沈华浩教授团队发现了CCL6-CCR1信号轴调控哮喘的新机制。该团队前期发表在Cell Res 2018的研究发现,嗜酸性粒细胞主要通过分泌CCL6,造成骨髓造血干细胞动员增加、嗜酸性粒细胞定向分化增强[2],但是CCL6的确切功能,及其在过敏性哮喘中的致病作用并不清楚。
CCL6-CCR1轴在哮喘炎症中的关键调控作用
CCL6/15/23是同属于趋化因子NC6家族,沈华浩教授团队研究发现,CCL6/15/23均由嗜酸性粒细胞主要分泌,并首次确认了CCL6可以直接激活受体CCR1及其下游信号通路。在小鼠中敲除CCL6,可显著缓解哮喘炎症中的嗜酸性粒细胞浸润、气道炎症、粘液高分泌等病理表现,骨髓中的嗜酸性粒细胞分化也被抑制。CCL6的人类同源因子CCL15和23在哮喘患者的血浆中也有明显增加,支持了该发现的临床意义。
嗜酸性粒细胞是由骨髓中的造血干细胞分化而来,传统观点认为,在过敏原的刺激下,上皮细胞、TH2细胞等免疫细胞分泌IL5等多种细胞因子动员干细胞分化,最终产生大量嗜酸性粒细胞向肺部募集,引起肺部炎症。该研究发现,嗜酸性粒细胞自身也会不断产生的CCL6,来促进了造血干细胞向其自身的分化增加。而敲除CCL6或其受体CCR1则可以阻止过敏原刺激下的干细胞定向分化,从而缓解气道炎症。这就形成了一个完整的哮喘正反馈循环机制,其中,由嗜酸性粒细胞主导的CCL6-CCR1信号轴是关键环节。
CCL6-CCR1信号轴作为哮喘治疗新靶点
沈华浩教授团队研究证实了CCL6激活CCR1偶联的Gαi蛋白以及下游信号通路蛋白发生磷酸化,从而促进造血干细胞活化,为CCL6-CCR1信号轴提供了可靠的证据。该研究中CCR1敲除或靶向CCR1抑制剂BX471,能有效抑制哮喘中的嗜酸性粒细胞分化,达到缓解哮喘炎症的效果,提示靶向CCR1在过敏性气道炎症疾病中的应用价值。在既往的哮喘靶向治疗中,趋化因子抗体和相关受体拮抗剂的临床试验均以失败告终[3],而该研究则解析了趋化因子和受体CCL6-CCR1信号轴在哮喘炎症中的关键作用,不仅为嗜酸性粒细胞在哮喘炎症中的调控作用提供了新的见解,而且为趋化因子及受体在哮喘靶向治疗中的应用提供了重大研究突破。
该文的第一作者为浙江大学医学院2015级直博生杜旭菲,2017级博士研究生李飞、基础医学系张超副教授、附属第二医院呼吸与危重症医学科李娜副主任医师和黄华琼副主任医师为共同第一作者,沈华浩教授和应颂敏教授为论文的共同通讯作者。该研究得到了国家自然科学基金重点项目和国际合作与交流项目、科技部重点研发计划的资助。
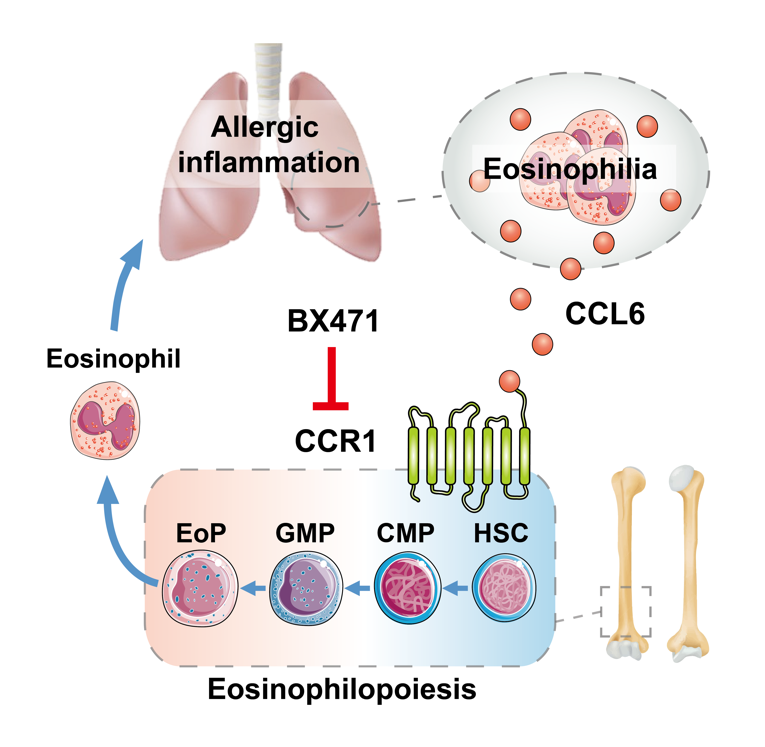
示意图:CCL6-CCR1信号轴调控哮喘炎症
参考文献
1. Du X#, Li F#, Zhang C#, Li N#, Huang H#, Shao Z, Zhang Min, Zhan X, He Y, Ju Z, Li W, Chen Z, Ying S*, Shen H*. Eosinophil-derived chemokine (hCCL15/23, mCCL6) interacts with CCR1 to promote eosinophilic airway inflammation. Sig Transduct Target Ther 6, 91 (2021). https://doi.org/10.1038/s41392-021-00482-x
2. Zhang C#, Yi W#, Li F, Du X, Wang H, Wu P, Peng C, Luo M, Hua W, Wong CC, Lee JJ, Li W, Chen Z, Ying S*, Ju Z*, Shen H*. Eosinophil-derived CCL-6 impairs hematopoietic stem cell homeostasis. Cell Res. 2018 Mar 28(3):323-335
2021年2月28日,浙江大学医学院附属第二医院呼吸与危重症医学科、浙江省呼吸疾病诊治及研究重点实验室沈华浩教授、应颂敏教授为共同通讯作者,在靶向治疗领域著名期刊Signal Transduction and Targeted Therapy(IF:13.493)上在线发表了题为“Eosinophil-derived chemokine (hCCL15/23, mCCL6) interacts with CCR1 to promote eosinophilic airway inflammation”的研究论文[1]。该研究在国际上首次构建趋化因子CCL6基因敲除小鼠,首次发现嗜酸性粒细胞通过CCL6-CCR1信号轴对哮喘炎症环路的正反馈调控新机制,并通过体外实验首次证实CCL6的受体为G蛋白偶联受体(GPCR)CCR1,靶向CCR1的治疗可以在体内外抑制嗜酸性粒细胞的分化和气道炎症,揭示了靶向CCL6-CCR1轴可用于哮喘临床治疗的新干预靶点。
支气管哮喘和趋化因子
支气管哮喘(简称哮喘)是最常见的慢性疾病之一,全球的哮喘患者有近4亿人,在我国已有6000多万的哮喘患者。哮喘的防治已经成为了重要的公共卫生与医疗保健问题,对哮喘疾病发病机制和治疗靶点的深入探究也至关重要。哮喘患者中,超过半数是由过敏性诱发的TH2细胞主导的2型免疫反应,包括嗜酸性粒细胞在内的多种免疫细胞组分都发挥了重要作用,其中嗜酸性粒细胞浸润、粘液高分泌和气道高反应性是其主要病理特征,但嗜酸性粒细胞调控过敏性炎症的关键机制尚未完全清楚。
趋化因子是一类小分子蛋白,作用于细胞表面的趋化因子受体。趋化因子受体是一类G蛋白偶联受体(GPCR),二者结合介导免疫细胞运输、调节炎症反应。在过敏性哮喘中,除了嗜酸性粒细胞趋化因子(Eotaxin)-CCR3等经典的调控机制以外,沈华浩教授团队发现了CCL6-CCR1信号轴调控哮喘的新机制。该团队前期发表在Cell Res 2018的研究发现,嗜酸性粒细胞主要通过分泌CCL6,造成骨髓造血干细胞动员增加、嗜酸性粒细胞定向分化增强[2],但是CCL6的确切功能,及其在过敏性哮喘中的致病作用并不清楚。
CCL6-CCR1轴在哮喘炎症中的关键调控作用
CCL6/15/23是同属于趋化因子NC6家族,沈华浩教授团队研究发现,CCL6/15/23均由嗜酸性粒细胞主要分泌,并首次确认了CCL6可以直接激活受体CCR1及其下游信号通路。在小鼠中敲除CCL6,可显著缓解哮喘炎症中的嗜酸性粒细胞浸润、气道炎症、粘液高分泌等病理表现,骨髓中的嗜酸性粒细胞分化也被抑制。CCL6的人类同源因子CCL15和23在哮喘患者的血浆中也有明显增加,支持了该发现的临床意义。
嗜酸性粒细胞是由骨髓中的造血干细胞分化而来,传统观点认为,在过敏原的刺激下,上皮细胞、TH2细胞等免疫细胞分泌IL5等多种细胞因子动员干细胞分化,最终产生大量嗜酸性粒细胞向肺部募集,引起肺部炎症。该研究发现,嗜酸性粒细胞自身也会不断产生的CCL6,来促进了造血干细胞向其自身的分化增加。而敲除CCL6或其受体CCR1则可以阻止过敏原刺激下的干细胞定向分化,从而缓解气道炎症。这就形成了一个完整的哮喘正反馈循环机制,其中,由嗜酸性粒细胞主导的CCL6-CCR1信号轴是关键环节。
CCL6-CCR1信号轴作为哮喘治疗新靶点
沈华浩教授团队研究证实了CCL6激活CCR1偶联的Gαi蛋白以及下游信号通路蛋白发生磷酸化,从而促进造血干细胞活化,为CCL6-CCR1信号轴提供了可靠的证据。该研究中CCR1敲除或靶向CCR1抑制剂BX471,能有效抑制哮喘中的嗜酸性粒细胞分化,达到缓解哮喘炎症的效果,提示靶向CCR1在过敏性气道炎症疾病中的应用价值。在既往的哮喘靶向治疗中,趋化因子抗体和相关受体拮抗剂的临床试验均以失败告终[3],而该研究则解析了趋化因子和受体CCL6-CCR1信号轴在哮喘炎症中的关键作用,不仅为嗜酸性粒细胞在哮喘炎症中的调控作用提供了新的见解,而且为趋化因子及受体在哮喘靶向治疗中的应用提供了重大研究突破。
该文的第一作者为浙江大学医学院2015级直博生杜旭菲,2017级博士研究生李飞、基础医学系张超副教授、附属第二医院呼吸与危重症医学科李娜副主任医师和黄华琼副主任医师为共同第一作者,沈华浩教授和应颂敏教授为论文的共同通讯作者。该研究得到了国家自然科学基金重点项目和国际合作与交流项目、科技部重点研发计划的资助。

示意图:CCL6-CCR1信号轴调控哮喘炎症
参考文献
1. Du X#, Li F#, Zhang C#, Li N#, Huang H#, Shao Z, Zhang Min, Zhan X, He Y, Ju Z, Li W, Chen Z, Ying S*, Shen H*. Eosinophil-derived chemokine (hCCL15/23, mCCL6) interacts with CCR1 to promote eosinophilic airway inflammation. Sig Transduct Target Ther 6, 91 (2021). https://doi.org/10.1038/s41392-021-00482-x
2. Zhang C#, Yi W#, Li F, Du X, Wang H, Wu P, Peng C, Luo M, Hua W, Wong CC, Lee JJ, Li W, Chen Z, Ying S*, Ju Z*, Shen H*. Eosinophil-derived CCL-6 impairs hematopoietic stem cell homeostasis. Cell Res. 2018 Mar 28(3):323-335
相关热词搜索:
上一篇:脾脏体积还能与肝细胞癌切除术后肝功能衰竭以及术后总生存率有关系?
下一篇:慢阻肺呼吸道感染期间是否增加吸药次数?
频道总排行
频道本月排行
热门购物
评论排行
- 2011年临床执业医师考试实践技能真...(13)
- 腋臭手术视频(12)
- 2008年考研英语真题及参考答案(5)
- 节食挑食最伤女人的免疫系统(5)
- 核辐射的定义和单位(5)
- CKD患者Tm与IMT相关(5)
- 齐鲁医院普外科开展“喉返神经监护...(5)
- windows7激活工具WIN7 Activation v1.7(5)
- 正常微循环(5)
- 美大学性教育课来真的 男女上阵亲...(4)